
科目: 来源: 题型:
【题目】有关晶体的结构如下图所示,下列说法中不正确的是( )
A.
在NaCl晶体中,距Na+最近的Cl﹣形成正八面体
B.
在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.
在金刚石晶体中,碳原子与碳碳键个数的比为1:4
D.
铜晶体为面心立方堆积,铜原子的配位数为12
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某有机物由C、H、O三种元素组成,球棍模型如图所示:

①含有的官能团名称是_______;
②写出此有机物与金属钠反应的化学方程式_______。
(2)四种常见有机物分子的比例模型示意图如下,其中甲、乙、丙为烃,丁为烃的衍生物。

①可以鉴别甲和乙的试剂为_________;
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
②上述物质中有毒、有特殊气味,且不溶于水、密度比水小的是_________(填名称),将其加入溴水中,振荡后静置,观察到的现象是_______。
③乙和丁的物质的量共1.5mol,完全燃烧需要的氧气的物质的量是_______。
(3)乳酸(![]() )是一种有机物,它在多种生物化学过程中起重要作用。
)是一种有机物,它在多种生物化学过程中起重要作用。
①1mol乳酸与足量的Na反应生成氢气的物质的量是_______。
②乳酸与铁粉反应生成乳酸亚铁,可用于治疗缺铁性贫血。反应的化学方程式是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2L的密闭容器中充入3mol气体A和2.5mol气体B,发生反应:3A(g)+B(g)xC(g)+2D(g)(正反应为吸热反应),5min时测得生成1mol D,C的平均反应速率v(C)=0.1molL﹣1min﹣1 , 试求:
(1)方程式中C的化学计量数x= .
(2)5min内A的平均反应速率v(A)= .
(3)5min时B的转化率为 .
(4)温度升高A的转化率(填“增大”或“减小”或“不变”下同),压强增大B的转化率 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.
在0~60s时段,反应速率v(N2O4)为 molL﹣1s﹣1
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0molL﹣1s﹣1的平均速率降低,经10s又达到平衡.T100℃(填“大于”或“小于”),判断理由是 .
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向(填“正反应”或“逆反应”)方向移动,判断理由是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上合成氨反应为:N2+3H2![]() 2NH3,回答下列问题:
2NH3,回答下列问题:
(1)反应过程中拆开的化学键是_______;
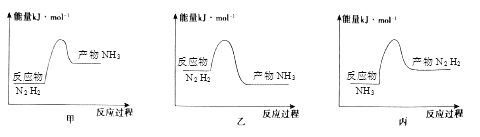
(2)反应放热,从价键角度分析,反应放热的原因是_______,下列图像正确的是_______。
(3)在体积是2L的密闭容器中开始加入1molN2,3molH2,反应过程浓度中,物质的浓度与时间的关系如图所示。

①t1时生成NH3的物质的量是_______;用H2表示的化学反应速率υ(H2)=_______。
②下列各项能表明反应达到化学平衡状态的是_______。
A.容器中气体的密度保持不变
B.容器中气体的压强不变
C.氨气的含量不变
D.拆开3molH—H键同时形成6molN—H键
(4)下列措施中能提高合成氨反应化学反应速率的是_______。
A.使用高效催化剂 B.恒温恒容再充入氢气 C.降低反应温度 D.扩大容器体积
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中提取碘单质,成熟的工艺流程如下

下列关于海水制碘的说法,正确的是
A. 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B. 可用酒精萃取碘水中的I2
C. 沸水浸泡海带灰的目的是为了加快I-的溶解,并使之溶解更充分
D. 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:X(s)+Y(g)![]() 2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是
2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是
①单位时间内生成1molX的同时消耗2molZ ②Z的体积分数不再变化
③体系的压强不再改变 ④Y、Z的物质的量浓度比为1:2
⑤Y的转化率不再改变的状态 ⑥混合气体的密度不再改变的状态
A. 仅①④ B. ①③④ C. ①④⑤ D. ②③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】碘化钾可用于有机合成、制药等领域,它是一种白色立方结晶或粉末,易溶于水。有两个学习小组查阅资料后,分别设计以下实验装置制备KI:
【查阅资料】:
(1)3I2+6KOH═KIO3+5KI+3H2O
(2)H2S是有剧毒的酸性气体,具有较强还原性,水溶液称氢硫酸(弱酸);
(3)HCOOH(甲酸)具有强烈刺激性气味的液体,具有较强还原性,弱酸;
(4)在实验条件下,S2-、HCOOH分别被KIO3氧化为SO42-、CO2。
Ⅰ组. H2S还原法,实验装置如图:

实验步骤如下:
①在上图所示的C中加入127g研细的单质I2和210g 30%的KOH 溶液,搅拌至碘完全溶解。
②打开弹簧夹向其中通入足量的 H2S。
③将装置C中所得溶液用稀H2SO4酸化后,置于水浴上加热10min。
④在装置C的溶液中加入BaCO3,充分搅拌后,过滤、洗涤。
⑤将滤液用氢碘酸酸化,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得产品145g。
Ⅱ组.甲酸还原法,实验装置如图:

实验步骤如下:
⑥在三颈瓶中加入 127g 研细的单质I2和210g 30%的 KOH 溶液,搅拌至碘完全溶解。
⑦通过滴液漏斗向反应后的溶液中滴加入适量HCOOH,充分反应后,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得产品 155g。
回答下列问题;
(1)图中装置 A 中发生反应的离子方程式为__________;装置 B 中的试剂是_________。
(2)D装置的作用是___________。
(3)步骤④的目的是_____________________ 。
(4)步骤⑤中“滤液用氢碘酸酸化”的目的是__________________ 。
(5)Ⅱ组实验的产率为__________________。
(6)Ⅱ组实验中,加入HCOOH发生氧化还原反应的离子方程式为_______________。
(7)与Ⅰ组相比较,Ⅱ组实验的优点是(至少答出两点即可)__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意回答下列问题:
某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55molL﹣1 , 盐酸的浓度为0.5molL﹣1 , 每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2﹣t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(1)已知盐酸、NaOH溶液密度近似为1.00gcm﹣3 , 中和后混合液的比热容c=4.18×10﹣3kJg﹣1℃﹣1 , 则该反应的中和热为△H= .
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会(填“偏大”、“偏小”或“不变”),其原因是 .
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热(填“偏大”、“偏小”或“不变”).
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M是合成一种广谱杀菌剂的重要中间产物,以下是合成M的一种路线:

已知:G→H、J→M的反应中原子利用率均为100%。
回答下列问题:
(1)A分子中含氧官能团的名称是_________________,H→J的反应类型是_____________。
(2)物质X的名称是_______________, 物质Y的结构简式是_________________。
(3)写出下列反应的化学方程式:
C→D:_____________________________________
E→F:_____________________________________
(4)同时符合下列条件的F的同分异构体共有_______种,写出其中任意两种同分异构体的结构简式_________________。
①不与NaHCO3溶液反应 ②能发生银镜反应
③遇FeCl3溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
(5)根据上述合成路线中的信息,写出以1,3—丙二醇为原料制备![]() 的合成路线(无机试剂任选)______________________________________。
的合成路线(无机试剂任选)______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com