
科目: 来源: 题型:
【题目】已知 X2(g)+Y2 (g)2Z(g),X2、Y2、Z 的起始浓度分别为 0,1molL﹣1、0.3molL﹣1 , 0.2molL﹣1 . 在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A.Z 为 0.4molL﹣1
B.X 为 0.2 molL﹣1
C.Y 为 0.4 molL﹣1
D.Z 为 0.3 molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上从含有Cr2O72﹣和Cr3+的废水中回收铬的工艺流程如图所示: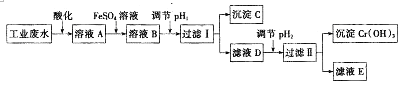
己知:①2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O;
②常温下,Ksp[(Fe(OH)3]=4.0×10﹣38;Ksp[(Cr(OH)3]=1.0×10﹣32
③当离子浓度小于1.0×10﹣5molL﹣1时,认为沉淀完全
请回答下列问题:
(1)酸化后的溶液A显色.
(2)配制FeSO4溶液时,除了加水外还需要加入的试剂是(填试剂名称).
(3)向溶液A中加入FeSO4溶液发生反应的离子方程式为 .
(4)沉淀C的化学式为 , 要使Cr3+沉淀完全pH2值至少为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组欲测定市场上某H2O2消毒液质量分数,现进行如下操作
己知:2MnO4﹣+5H2O2+6H+═2Mn2++8H2O+5O2
操作①:取10.00mLH2O2溶液(密度为1.00gmL﹣1)置于锥形瓶中加水稀释,再加稀硫酸酸化;
操作②:用0.200 0molL﹣1KMnO4溶液滴定;
操作③:用同样方法滴定,4次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL、22.00mL.请回答下列问题:
(1)滴定时盛装KMnO4溶液应选取的仪器是(填序号).
A.50mL酸式滴定管
B.50mL碱式滴定管
C.25mL酸式滴定管
D.25mL碱式滴定管
(2)是否需要选用指示剂(填“是”或“否”)达到滴定终点的现象是 .
(3)分析数据,计算该H2O2溶液中溶质的质量分数为(保留三位有效数字).
查看答案和解析>>
科目: 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL,某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20molL﹣1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如表
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10ml | 20.30ml |
第二次 | 0.30ml | 20.10ml |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 molL﹣1 .
(2)在配制250mL0.20molL﹣1的氢氧化钠标准溶液时,用到的仪器除托盘天平、烧杯、玻璃棒还有 .
(3)以下操作造成测定结果偏高的有 .
A.配制标准溶液的氢氧化钠固体中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是资源的宝库,含有丰富的化学元素。
(1)在电解饱和食盐水的实验中,阳极产物的检验方法是________________________。
(2)目前从海水中提溴(Br 2 )大致有以下步骤。
①向浓缩的海水中通入Cl2,将海水中的 Br- 氧化为 Br2 。
②用热空气将 Br 2 从上述溶液中吹出,并由浓 Na 2 CO 3 溶液吸收,转变为 NaBr、NaBrO 3和CO2 。吸收1 moL Br 2 需消耗 Na2CO3 ________moL。
③再将所得混合溶液用稀硫酸酸化,得到浓度较高的溴水,配平该反应的离子方程式。
____Br— +____ BrO3— +____H + →____ Br2 +____H2O
(3)碘主要从海带中提取,某课外兴趣小组的同学用海带为原料制得少量碘水之后,欲用CCl4从碘水中萃取碘,请简述能用CCl4从碘水中萃取碘的原因是:___________。
(4)同温同浓度的Na2CO3溶液、NaHCO3溶液,PH大小顺序为________ 。NaHCO3溶液中滴入少量氢氧化钠溶液,溶液中c(CO32-)_______(填变大或变小),请用平衡理论解释发生这种变化的原因____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I. 利用反应:6NO2 + 8NH3![]() 7N2 + 12 H2O处理NO2。
7N2 + 12 H2O处理NO2。
II. 一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q (Q>0) 。
SO3(g)+NO(g) Q (Q>0) 。
III. CO可用于合成甲醇,反应方程式为:CO(g) + 2H2(g)![]() CH3OH(g) 。
CH3OH(g) 。
(1)硫离子最外层电子的电子排布式为__________________,氨气分子的电子式为___________,氨气分子属于___________分子(填“极性”或者“非极性”)。
(2)C、O、S、N这四种元素中属于同周期元素的非金属性由强到弱的顺序为_______________,能证明其递变规律的事实是(________)
a、最高价氧化物对应水化物的酸性 b、气态氢化物的沸点
c、单质与氢气反应的难易程度 d、其两两组合形成的化合物中元素的化合价
(3)对于I中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =_______________。
(4)对于II中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是_____________
a. 体系压强保持不变 b. NO2浓度保持不变
c. NO2和SO3的体积比保持不变 d. 混合气体的平均相对分子质量保持不变
(5)请写出II中反应的平衡常数表达式K=_____________________________________。如果II中反应的平衡常数K值变大,该反应___________
a.一定向正反应方向移动 b. 平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,逆反应速率先增大后减小
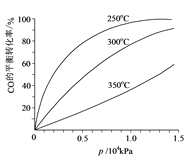
(6)对于III中的反应,CO在不同温度下的平衡转化率与压强的关系如图示。实际生产条件控制在250℃、1.3×104 kPa左右,简述选择此压强的理由:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574 kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160 kJ/mol
③H2O(g)═H2O(l)△H=﹣44.0 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式: .
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=akJmol﹣1 .
在T1℃时,反应进行到不同时间测得各物质的浓度如表:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率V(NO)=;计算该反应的平衡常数K=;
②30min后,只改变某一条件,根据上表中的数据判断改变的条件可能是(填字母编号).
A.通人一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通人一定量的NO E.加入一定量的活性炭
③若50min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率(填“升高”或“降低”),a 0(填“>”或“<”).
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是_______。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

A处其电极反应式为___________;
(3)某元素的同位素![]() ,它的氯化物XCl21.11g溶于水配成溶液后,加入1mo1/L的AgNO3溶液20mL,恰好完全反应。若这种同位素的原子核内有20个中子,Z的值为_____,A的值为______。
,它的氯化物XCl21.11g溶于水配成溶液后,加入1mo1/L的AgNO3溶液20mL,恰好完全反应。若这种同位素的原子核内有20个中子,Z的值为_____,A的值为______。
(4)将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:
NH4Br(s)![]() NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g)![]() Br2(g)+H2(g)
Br2(g)+H2(g)
2min后,测知c(H2)=0.5mo/L,c(HBr)=4mol/L。若上述反应速率用v(NH3)表示,则v(NH3)=_____
查看答案和解析>>
科目: 来源: 题型:
【题目】明代《本草纲目》中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A.萃取B.蒸发C.蒸馏D.升华
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com