
科目: 来源: 题型:
【题目】厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A—表示乳酸根离子)。下列说法正确的是( )
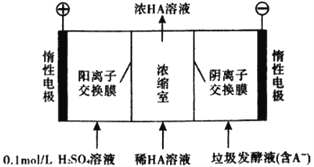
A. 通电后,阳极附近pH增大
B. 电子从负极经电解质溶液回到正极
C. 通电后,A—通过阴离子交换膜从阴极进入浓缩室
D. 当电路中通过2 mol电子的电量时,会有1 mol的O2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】通常检测SO2含量是否达到排放标准的反应原理是SO2 +H2O2 + BaCl2 ===BaSO4↓+ 2HCl。NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 0.1 mol BaCl2晶体中所含微粒总数为0.1NA
B. 25 ℃时,pH =1的HCl溶液中含有H+的数目为0.1NA
C. 17 g H2O2中含有非极性键数目为0.5NA
D. 生成2.33 g BaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔(C2H2)是制造草酸、乙醛、醋酸等有机化合物的基本原料。
(1)某小组同学以电石(主要成分为CaC2,含少量CaS及Ca3P2等杂质)为原料,利用下图所示实验装置(夹持装置略去,下同)制备C2H2。

①仪器a的名称为__________________________。
②CaC2的电子式为________________________________。
③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为________________________________。
(2)该小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸能将乙炔气体氧化为草酸(H2C2O4),实验装置如下图所示。

①装置E的作用是_________________________________________。
②装置D中生成H2C2O4的化学方程式为_________________________________。
③装置D中锥形瓶内的液体经过___________(填操作名称)、洗涤、干燥等步骤得到H2C2O4·2H2O晶体。
(3)该小组同学测定了晶体中H2C2O4·2H2O的质量分数,实验步骤如下:
i.准确称取mg晶体,加入适量的蒸馏水溶解,再加入少量稀硫酸;
ii.将i所得溶液用c mol/LKMnO4标准溶液进行滴定,滴定时KMnO4被还原为Mn2+,滴定至终点时消耗标准溶液VmL。
①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是____________。
②晶体中H2C2O4·2H2O的质量分数为_________(用含m、c、V的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某公司设计的用于驱动潜艇的液氨﹣液氧燃料电池示意图如下,有关说法正确的是( )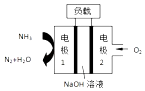
A.电池总反应为:4NH3+3O2=2N2+6H2O
B.电池工作时,OH﹣向正极移动
C.电极 2 发生的电极反应为:O2+4H++4e﹣=2H2O
D.电流由电极 1 经外电路流向电极2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组元素性质的递变情况错误的是( )
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl元素最高正价依次升高
C. N、O、F第一电离能依次增大
D. Na、K、Rb电负性逐渐减小
查看答案和解析>>
科目: 来源: 题型:
【题目】分离下列三组混合物依次采取的方法正确的是:①水和乙醇②植物油和氯化钠溶液③碳酸钙和氯化钙的溶液( )
A.蒸发、蒸馏、萃取
B.蒸馏、分液、过滤
C.分液、过滤、加热升华
D.蒸馏、萃取、分液
查看答案和解析>>
科目: 来源: 题型:
【题目】抗过敏药物H 可通过如下合成路线制备。

已知: ![]()
(1)A物质的名称为_______________,B中含氧官能团的名称为__________________。
(2)由B生成C的反应类型为________________,由E 生成F 的反应类型为_______________。
(3)下列试剂可用于鉴别![]() 和
和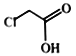 的有________(填标号)。
的有________(填标号)。
a.NaOH 溶液 b.小苏打溶液 c.AgNO3溶液 d.溴的CCl4溶液
(4)由D生成E的化学方程式为____________________________________。
(5)己知联苯由两个苯环通过单键连接而成(![]() ),分子中苯环间的单键可以自由旋转。则B的同分异构体中含联苯基团且能发生银镜反应的至少有____种。
),分子中苯环间的单键可以自由旋转。则B的同分异构体中含联苯基团且能发生银镜反应的至少有____种。
(6)M(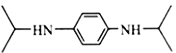 )是制备合成染料、颜料的重要中间产物。参照上面合成路线,请以丙酮(
)是制备合成染料、颜料的重要中间产物。参照上面合成路线,请以丙酮(![]() )和对苯二胺(
)和对苯二胺(![]() )为主要有机原料设计M的合成路线________________(其它试剂任选)。
)为主要有机原料设计M的合成路线________________(其它试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4、CH3OH既是重要的化工原料,又是未来重要的能源物质。
(1)将1.0 mol CH4和2.0 mol H2O(g) 通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
(2)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g) ![]() CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________(填选项序号)。
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________(填选项序号)。
a.消耗1 mol CO2同时生成1 mol CH3OH b.容器内压强保持不变
c.混合气体的密度保持不变 d.CH3OH(g)的浓度保持不变
(4)以KOH为电解质的甲醇-空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。 回答下列问题:

①该原电池的正极是____(填“甲”或“乙”),电解过程中乙电极附近pH____(填“增大”或“减小”);
②负极的电极反应式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能在水中大量共存的一组离子是
A.NH4+、Na+、Cl-、SO42-B.H+、Na+、NO3-、CO32-
C.K+、Ba2+、OH-、SO42-D.K+、Ag+、NO3-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】积极保护生态环境可实现人与自然的和谐共处.
①下列做法会加剧温室效应的是(填字母).
a.植树造林 b.燃煤供暖 c.风力发电
②下列防治“白色污染”的正确方法是(填字母).
a.使用可降解塑料 b.露天焚烧废弃塑料 c.直接填埋废弃塑料
③为减轻大气污染,多个城市已禁止燃放烟花爆竹.“禁止燃放烟花爆竹”的标识是(填字母).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com