
科目: 来源: 题型:
【题目】某原电池的装置如图所示,看到b极上有红色金属析出,回答下列问题:

①若a、b是两种活动性不同的金属,则活动性a____b(填>、<或=);
②电路中的电子从____经导线流向_____(填a或b);
③溶液中的SO42-向________极移动(填a或b);
④若两电极分别是Al和C,则负极的电极反应式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L Na2CO3溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min后出现明显的红褐色 |
0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中红褐色沉淀产生的原因可用如下反应表示,请补全反应:_____________
![]() Fe2++
Fe2++ ![]() +
+ ![]() +
+ ![]() H2O
H2O ![]()
![]() Fe(OH)3 +
Fe(OH)3 + ![]() HCO3
HCO3
(2)实验II中产生FeCO3的离子方程式为__________________。
(3)为了探究实验III中NH4+所起的作用,甲同学设计了实验IV进行探究:
操作 | 现象 | |
实验IV | 向0.8 mol/L FeSO4溶液中加入________,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合 | 与实验III现象相同 |
实验IV中加入Na2SO4固体的目的是_________。
对比实验II、III、IV,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:_________,再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验III中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验I、II、III中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。

① 补全A中装置并标明所用试剂。____________
② 为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是____________。
(5)实验反思:经测定,实验III中的FeCO3纯度高于实验I和实验II。通过以上实验分析,制备FeCO3实验成功的关键因素是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在某无色透明的酸性溶液中,能共存的离子组是( )
A.Na+ 、K+、SO42-、OH-B.Cu2+、K+、SO42-、NO3
C.Na+、 K+、Cl、 NO3D.Fe3+、K+、SO42-、Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】胶体区别于其它分散系的本质是( )
A.胶体的分散质粒子直径在1 nm~100nm之间
B.胶体粒子带电荷并且在一定条件下能稳定存在
C.胶体粒子不能穿过半透膜,能通过滤纸空隙
D.胶体粒子能够发生布朗运动而且能产生丁达尔现象
查看答案和解析>>
科目: 来源: 题型:
【题目】第四周期的元素,如:钛(22Ti)、铁(26Fe)、砷、硒、锌等及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为___________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有______种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是______________。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_________________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是________________________。
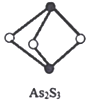
(4)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如图,As原子的杂化方式为____________,雌黄和SnCl2在盐酸中反应转化为雌黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式__________________________。SnCl4分子的空间构型为______________。
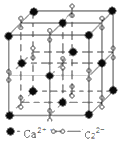
(5)高子化合物CaC2的一种晶体结构如图所示。该物质的电子式___________。一个晶胞含有的π键平均有___________个。
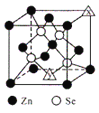
(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为___________(填元素符号);该晶胞中硒原子所处空隙类型为___________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为___________;若该晶胞密度为pgcm-3,硒化锌的摩尔质量为Mgmol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a 为___________nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,错误的是( )
A.化学反应必然伴随能量变化
B.化学变化中的能量变化主要是由化学键变化引起的
C.化学反应中的能量变化的大小与反应物的质量多少无关
D.能量变化是化学变化的基本特征之一
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向1 L pH=10的NaOH溶液中持续通入CO2 . 通入CO2的体积(V)与溶液中水电离出的c(OH﹣)的关系如图所示.下列叙述不正确的是( ) 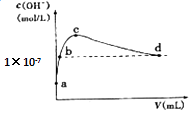
A.d点溶液中:c(Na+)═2c(CO32﹣)+c(HCO3﹣)
B.c点溶液中:c(Na+)>c(HCO3﹣)>c(CO32﹣)
C.b点溶液中:c(H+)=1×10﹣7molL﹣1
D.a点溶液中:水电离出的c(H+)=1×10﹣10molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】I .含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II.从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)B的结构简式______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:______________,反应类型:________。
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:______________________,反应类型:________。
III.已知乙烯能发生以下转化:

(1)C中含官能团名称_________;
(2)写出B与D反应的化学方程式_______________________;反应类型:________。
(3)写出反应③的化学方程式:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.“一酸两浸,两碱联合”法是实现粉煤灰(含SiO2、Al2O3、Fe2O3、CaO、MgO等)综合利用的新工艺。聚合氯化铝铁(PAFC)化学式为:[Al2(OH)nCl6-n]m·[Fe2(OH)xCl6-x]y,是一种新型高效的净水剂。工业流程如下:

回答下列问题:
(1)实际工业中“酸浸”、“碱浸”均不能充分反应,滤渣A中主要含有SiO2、Al2O3。“纯碱混合焙烧”中,它们分别发生反应的化学方程式为_________________、_________________。
(2)滤液混合后“蒸发”的作用是________________________________。
(3)“电解”时阳极的电极反应式为________________。
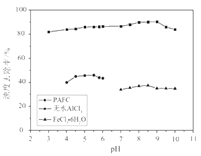
(4)PAFC、无水AlCl3、FeCl3·6H2O用量均为25 mg·L-1时,处理不同pH污水的浊度去除率如图所示,PAFC的优点是___________________________。
Ⅱ.(5)25℃时,用0.1mol/L的CH3COOH溶液滴定20mL0.1mol/L的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,Ka的表达式为___________。
(6)常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com