
科目: 来源: 题型:
【题目】N2+3H2![]() 2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
A. 达到平衡时,反应速率:v(正)=v(逆)=0
B. 恒温恒压下,充入少量He,反应速率减慢
C. 升温正反应速率加快,逆反应速率减慢
D. 若在反应的密闭容器加入1 mol N2和过量的H2,最后能生成2 mol NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图a、b、c、d均为铂电极,供选择的电解质溶液如下表( )
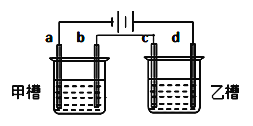
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
组 | A | B | C | D |
甲槽 | NaOH | Cu(NO3)2 | KCl | Na2SO4 |
乙槽 | CuSO4 | NaCl | AgNO3 | NaNO3 |
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100ml﹣1).
(1)Ⅰ.实验步骤:
用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到转移到 (填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.1000mol/L NaOH溶液的碱式滴定管的初始读数.
滴定.当时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(4)Ⅱ.实验记录:
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V= ![]() mL=15.24mL.指出他的计算的不合理之处: .
mL=15.24mL.指出他的计算的不合理之处: .
(5)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子交换反应,需查找在一定温度下醋酸和苯甲酸的(填写序号)
a.电离常数 b.溶解度
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号) .
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25s内的反应进程.
(1)前20秒内O2的平均生成速率:mol/(Ls)
(2)在某温度下达到平衡后,不改变其他条件,向该容器中再加入少量的NO2 , 平衡移动的方向是 , NO2的平衡转化率 68.75%(填“>”、“<”或“=”),NO的体积百分含量 (填“增大”、“减小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】硫、锌及其化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为____________________;锌的第二电离能I2(Zn)小于铜的第二电离能I2(Cu),其原因是____________________________________。
(2)O和S处于同一主族。H2O及H2S中,中心原子的杂化方式相同,键长及键角如图所示。

①H2O分子中的键长比H2S中的键长短,其原因是___________________________。
②H2O分子中的键角∠HOH比H2S分子中的键角∠HSH大,其原因是_________________。
(3)单质硫与热的NaOH浓溶液反应的产物之一为Na2S3。S32-的空间构型为_________,中心原子的杂化方式为_________________。
(4)噻吩( )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有_______个σ键,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为______________。
),则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
)的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
(5)硫化锌是一种半导体材料,其晶胞结构如图所示。

①已知A点的原子坐标参数为(0,0,0);B点的原子坐标参数为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为__________。
),则C点的原子坐标参数为__________。
②硫化锌晶体的密度为4.05g·cm-3,晶胞边长为anm,设NA为阿伏加德罗常数的数值,则a=_________(列出计算表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com