
科目: 来源: 题型:
【题目】如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )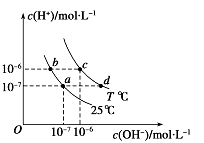
A.只采用升温的方式,可由a点变成d点
B.T<25
C.b点和c点pH均为6,溶液呈酸性
D.两条曲线上任意点均有c (H+) ×c (OH-)=Kw
查看答案和解析>>
科目: 来源: 题型:
【题目】为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用。
(1)下列说法正确的是__________(填序号)。
A. CH4与CO2分子均为含有极性共价键的非极性分子 B. 第一电离能:O>N>C
C. 沸点高低:CH4>SnH4>GeH4>SiH4 D. CH![]() 离子的空间构型为平面正三角形
离子的空间构型为平面正三角形
(2)CH4和CO2在Ni催化作用下反应可获得化工原料CO和H2。
①Ni基态原子核外电子排布式为__________。
②与CO互为等电子体的阴离子的电子式为__________,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有σ键的数目为__________。
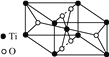
(3)CH4和CO2在含有钛氧化物的某种催化剂作用下,可直接转化为CH3COOH。
①CH3COOH中C原子轨道杂化类型为__________;
②钛氧化物晶胞结构如图所示,写出其化学式:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)及其化合物在生产、医疗、科技等方面有许多应用
(1)中国自古“信口雌黄”、“雄黄入药”之说。雄黄As2S3和雌黄As4S4都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。一定条件下,雌黄和雄黄的转化关系如图所示。
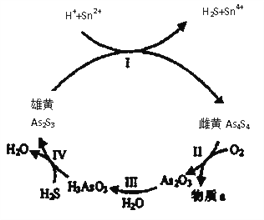
①雌黄和雄黄中S元素均为-2,I中发生的离子方程式是__________。
②Ⅱ中,雌黄在空气中加热至300℃时会产生两种物质,若4.28g As4S4反应转移0.28mole-,则a为__________(填化学式);砒霜(As2O3)可水将氧化成H3AsO4而除去,该反应的化学方程式为:__________。
(2)AsH3是一种很强的还原剂,室温下, 0.4mol AsH3气体在空气中自燃,氧化产物为As2O3固体,放出b kJ 热量,AsH3自燃的热化学方程式是:__________。
(3)将Na3AsO3(aq)+I2(aq)+H2O(l)![]() Na2HAsO4(aq)+NaI (aq)设计成原电池如图所示,放电时电流强度(I)与时间关系如图所示.
Na2HAsO4(aq)+NaI (aq)设计成原电池如图所示,放电时电流强度(I)与时间关系如图所示.
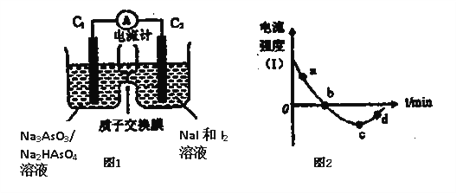
①如图中表示在该时刻上述可逆反应达到平衡状态的点是__________(填字母)。
②已知:a点对应如图中电流由C1极经外电路流向C2极。则d点对应的负极的反应式为__________。
③如图中,b→c改变条件可能是__________(填代号)。
A.向左室中加入适量的浓Na3AsO3溶液 B.向左室中加入适量的烧碱溶液
C.向右室中加入适量的浓KI溶液 D. 向右室中加入适量的稀硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。用氧化还原观点分析,这“另一物质”在反应中作
A.氧化剂B.还原剂
C.氧化产物D.还原产物
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用铁粉制备摩尔盐的操作流程如下:
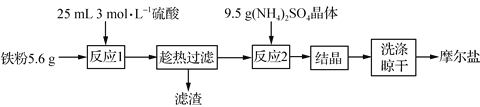
(1)流程中“趁热”过滤的原因是__________。
(2) 反应1制得硫酸亚铁的物质的量理论上应小于__________mol。
(3)为确定摩尔盐的化学式,进行如下实验:现称取4.704 g新制摩尔盐,溶于水配制成100.0 mL溶液,再将该溶液分成两等份。
向其中一份溶液中加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸
变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体2.796 g。
另一份溶液用0.050 0 mol·L-1 K2Cr2O7酸性溶液滴定,当Cr2O![]() 恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00 mL。
恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00 mL。
①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO![]() 离子沉淀完全(即该离子浓度须小于1×10-5 mol·L-1),则此时c[(Ba(OH)2]≥__________mol·L-1。
离子沉淀完全(即该离子浓度须小于1×10-5 mol·L-1),则此时c[(Ba(OH)2]≥__________mol·L-1。
②确定该摩尔盐的化学式(写出计算过程)。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:

请回答下列问题:
(1)滤渣1的化学式为_______,
(2)沉淀X的化学式为______________。
(3)“转化Ⅱ”中主要反应的离子方程式为___________________________。
(4)“一系列操作”包括过滤、洗涤、干燥。洗涤沉淀的操作为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】国家规定,酿造食醋的总酸含量标准为3.5~5.0 g/100 mL(总酸含量即100 mL食醋中CH3COOH的质量).某化学兴趣小组为测定某市售食醋的总酸含量,进行了实验.实验后,得知10.0mL该食醋样品与7.5 g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应.计算该市售食醋样品中的总酸含量,并说明是否符合国家标准.(假设该市售食醋样品中其他物质不与氢氧化钠发生反应)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
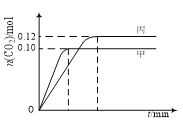
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的大
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com