
科目: 来源: 题型:
【题目】现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4 , ③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是( )
A.④>③>①=⑤>②
B.①=②>③>④>⑤
C.②>①>③>④>⑤
D.④>③>①>⑤>②
查看答案和解析>>
科目: 来源: 题型:
【题目】NO2为红棕色气体,可在火箭燃料中作氧化剂。回答下列问题:
(1)火箭用N2H4和NO2作燃料,产物绿色无污染,该反应的化学方程式为____________。
(2)为探究NO2和铁粉反应的产物,某小组按下图所示装置进行实验。
已知:①二者反应可能的还原产物为N2或NO
②沸点:NO2(21℃),NO(-152℃)
③酸性KMnO4溶液能氧化NO生成NO3-

①按上图所示组装完实验仪器后,下一步操作为______________________________。
②实验前需利用气体X将装置的空气排净,气体X可以为_______(填标号)。
A.Ar B.H2 C.CO D.NO2
③排净空气后,后续实验的最佳操作顺序是___c、b(填标号)。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.打开K1和K2,关闭K3,缓缓通入气体X
d.打开K1和K3,关闭K2,缓缓通入NO2 e.关闭K1,停止通入NO2
④装置B的作用是__________________________________。
(3)分析NO2和铁粉反应的产物
①实验过程中A、C装置的物质均无明显颜色变化,D收集到无色气体。由此可推知气体产物为____________________________。
②取少量固体产物于试管,先加入盐酸充分溶解,再加入KSCN溶液,溶液若无血红色,则产物不含三价铁。该方案是否可行并说明理由:_______________________________。
③实验得到的相关数据如下表:
玻璃管质量/g | Fe质量/g | 反应后(玻璃管+固体)/g |
m | 1.12 | m+1.52 |
综合实验现象和计算可知,固体生成物一定有______(填“FeO”Fe2O3”或“Fe3O4”);反应的方程式为______
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可利用地沟油制备乙醇,乙醇再加工制备多种化工材料。

(1)A的结构简式为_____________________________。
(2)“反应I”的现象是__________________________。
(3)B的官能团名称为______________________。
(4)实验室合成草酸二乙酯的步骤为:如图,在a中加入10.6g无水乙醇、9.0g无水草酸、脱水剂甲苯、催化剂TsOH(有机酸)和2~3片碎瓷片,在74~76℃充分反应。a中所得混合液冷却后依饮用水、饱和碳酸钠溶液洗涤,再用无水硫酸钠干燥。减压蒸馏,得到草酸二乙酯12.8g。
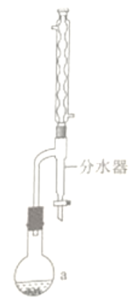
①仪器的名称是____,碎瓷片的作用是____________________________。
②合成过程最合适的加热方式是__________。
a.酒精灯直接加热 b.油浴 C.水浴 d.砂浴
③饱和碳酸钠溶液的作用是__________________________。
④合成草酸二乙酯的化学方程式为______________________________。
⑤草酸二乙酯的产率为____________________(保留小数点后一-位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL 0.0lmol/L CH3COOH 溶液中逐滴加入0.01mol/L的NaOH溶液,溶液中水电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是
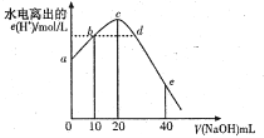
A. 从a到c,醋酸的电离始终受到促进
B. b、d两点溶液的pH相同
C. c点所示溶液中c(Na+)>c(CH3COO- )>c(OH- )>c(H+ )
D. e 点所示溶液中,c(Na+)=2c(CH3COO- )+2c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各种说法中错误的是( )
A. 形成配位键的条件是一方有空轨道另一方有孤电子对
B. 配位键是一种特殊的共价键
C. NH4NO3、H2SO4都含有配位键
D. 共价键的形成条件是成键原子必须有未成对电子
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求完成下列化学方程式或离子方程式。
(1)利用铝热反应焊接钢轨的化学方程式为_________________________。
(2)实验室利用二氧化锰和浓盐酸制取氧气的化学方程式为__________________。
(3)乙醇与金属钠反应的化学方程式为___________________________。
(4)苯与浓硫酸和浓硝酸混合液共热制取硝基苯的化学方程式为__________________。
(5)氯化铝溶液与氨水制备氢氧化铝的离子方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
A.x的值为2
B.A的转化率为60%
C.B的平衡浓度为0.8 mol/L
D.D的体积分数为25%
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化亚铜(Cu2O)是船舶防污剂的首选,可利用印刷电路板酸性蚀刻液(CuCl42-、Cl-、H+)和碱性蚀刻液[Cu(NH3)42+、NH4+、NH3、Cl-]来制备,工艺流程如下:
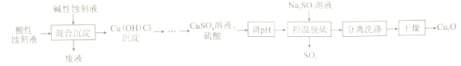
已知:强酸条件下,2Cu+==Cu+Cu2+
(1)不同pH下“混合沉淀”实验结果见下表。由表可知,pH应控制在______左右。
pH | 4.00 | 4.50 | 5.40 | 6.20 | 6.50 | 7.00 | 8.00 | 8.50 |
废液含铜量/g.L-1 | 19.5 | 2.4 | 2.0 | 0.3 | 0.2 | 2.0 | 8.3 | 17.0 |
(2)“混合沉淀”中废液的主要成分为______________(填化学式)
(3)“控温脱硫”生成Cu2O的离子方程式为_________;该过程产生的SO2经_____(填化学式)处理后生成可循环物质Na2SO3。
(4)“控温脱硫”过程中温度对Cu2O的产率影响及SO2在水中溶解度随温度变化如图所示:

下列说法正确的是_____
a.在60℃以下,温度越高,SO2越易逸出,有利于提高生产中硫原子利用率
b.反应温度的变化是影响Cu2O产率的主要因素
c.结合工业生产实际,温度应控制在溶液呈沸腾状态
d.低温时,Cu2O产率较低与SO2低温时的溶解度较大有关
(5)检验Cu2O是否洗涤干净的方法是______________________________。
(6)某工厂用V1,L含铜量120g·L-1的酸性蚀刻液和V2L含铜量160g·L-1的碱性蚀刻液制备Cu2O,最终得到产品mg,产率为____%。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列式子属于水解反应,且溶液呈酸性的是 ( )
A.HCO3- + H2O ![]() H3O+ + CO32-
H3O+ + CO32-
B.Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C.HS- + H2O ![]() H2S + OH-
H2S + OH-
D.NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,广泛用于玻璃、医药、冶金、皮革等工业。回答下列问题:
(1) H3BO3中B元素的化合价为______,其在元素周期表的位置是_________________。
(2)已知:A(OH)3+H2O![]() [Al(OH)4]-+H+,H3BO3的电离方程式为_______。酸性:H3BO3 _____(填*>”或“<”)Al(OH)3。
[Al(OH)4]-+H+,H3BO3的电离方程式为_______。酸性:H3BO3 _____(填*>”或“<”)Al(OH)3。
(3) H3BO3受热分解得到的B2O3和镁粉混合点燃可得单质B,生成单质B的化学方程式为________。
(4) H3BO3可用于生产储氢材料NaBH4。涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O
II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①“反应I”的类型为__________(填标号)。
A.取代反应 B.加成反应 C.加聚反应 D.氧化反应
②NaH的电子式为_______________。
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com