
科目: 来源: 题型:
【题目】以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下图所示。

回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为________________。
(2)已知:步骤①中涉及的主要反应是FeO·Cr2O3+Na2CO3+O2![]() Na2CrO4+Fe2O3+CO3(未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
Na2CrO4+Fe2O3+CO3(未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
(3)滤渣1的主要成分为MgO和_____(填化学式);滤渣2的成分是______(填物质名称)。
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和Na2SO4的混合溶液,发生反应的离子方程式为_______________。
(5)经步骤④酸化后的溶液中获得Na2Cr2O7·2H2O晶体的操作依次是蒸发浓缩、____、过滤、洗涤、干燥。
(6)该工艺的酸性废液中含有Cr2O72-,可向废液中加入绿矾(FeSO4·7H2O)还原处理。若处理20m3的Cr2O72-酸性废液,需要绿矾166.8g,则原废液中Cr2O72-的物质的量浓度为_____mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关甲烷和乙烷的说法中,错误的是
A.互为同系物
B.均不能使高锰酸钾酸性溶液褪色
C.在核磁共振氢谱图(1H核磁共振谱图)中,均只有1个吸收峰
D.二氯取代物均为两种
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是 ( ) 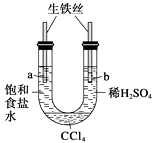
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-= Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)==2NO(g) △H =+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H =-221kJ·mol-1
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)],请写出此反应的热化学方程式_______。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
C(N2O6)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0,第3.00 min时体系压强为P1,则P1:P0=_______;2min~5.00min 内,O2 的 平 均反应速率为_____________。
②一定温度下,在恒容密闭容器中充人一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___。
a.NO2 和O2 的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)= v逆(N2 O5 ) d.气体的平均相对分子质量为43.2,且保持不变
(3)将2molN2 和4mo1H2 置于lL的恒容密闭容器中反应。测得不同温度、不同时间段内合成NH3 反应中N2 的转化率,得到数据如下表:

表中a、b、25%三者由大到小的顺序为_____,理由是_____。
(4)将(3)中实验得到的混合气体通入醋酸溶液中并恢复到25℃,当两者恰好反应时,生成的CH3COONH4溶液呈中性,则25℃时NH3·H2O的电离平衡常数Kb=______(已知:25℃时0.18mol/LCH3COOH 溶液中c(H+)=1.8×10-3mol/L)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室中,下列除杂![]() 括号内物质为杂质
括号内物质为杂质![]() 的方法正确的是
的方法正确的是![]()
![]()
A. 溴苯(溴):加入KI溶液,振荡,分液
B. 乙烷(乙烯):通过盛有![]() 溶液的洗气瓶
溶液的洗气瓶
C. 硝基苯(浓HNO3):将其倒入足量NaOH溶液中,振荡、静置,分液
D. 乙烯(SO2):通过盛有溴水的洗气
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:
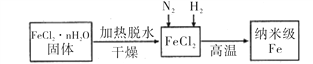
(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。

(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿色化学”要求从技术上、经济上设计可行的化学反应,使其尽可能减少对环境的负作用。下列化学反应中,不符合绿色化学概念的是
A. 用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O=(NH4)2SO3
B. 除去硝酸工业尾气中的氮氧化合物:NO2+NO+2NaOH=2NaNO2+H2O
C. 制硫酸铜:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. 制硫酸铜:2Cu+O2![]() 2CuO , CuO+H2SO4(稀)=CuSO4+H2O
2CuO , CuO+H2SO4(稀)=CuSO4+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com