
科目: 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下: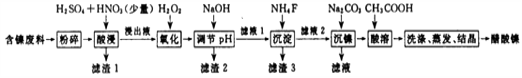
相关离子生成氢氧化物的pH和相关物质的溶解性如下表: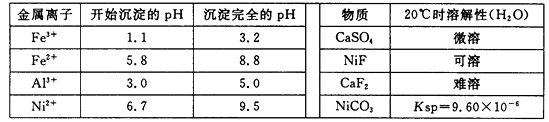
(1)调节pH步骤中,溶液pH的调节范围是。
(2)滤渣1和滤渣3主要成分的化学式分别是、。
(3)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式。
(4)沉镍前c(Ni2+)=2.0 mol· L-1 , 欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为g。(保留小数点后1位)
查看答案和解析>>
科目: 来源: 题型:
【题目】A,B,C都是金属,把A浸入C的硫酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极.A,B,C三种金属的活动性顺序为( )
A.A>B>C
B.A>C>B
C.B>A>C
D.B>C>A
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.如图是一个电化学过程的示意图。
请回答下列问题:
(1)写出通入CH3OH的电极的电极反应式。
(2)乙池中反应的化学方程式为 , 当乙池中B极质量增加5.4g,甲池中理论上消耗O2的体积为L(标准状况下),此时丙池中析出1.6g某金属,则丙池中的某盐溶液可能是(填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
Ⅱ.NO2 可通过点解制备绿色硝化试剂N2O5。下图是其原理示意图。
阳极区生成N2O5的电极反应式是。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.能与酸反应的氧化物,一定是碱性氧化物
C.含金属元素的离子不一定都是阳离子
D.金属阳离子被还原后,一定得到该元素的单质
查看答案和解析>>
科目: 来源: 题型:
【题目】苹果汁是人们喜爱的饮料,由于含有Fe2+,现榨的苹果汁会由淡绿色变为棕黄色,在这种苹果汁中加入维生素C,可避免该现象,这些现象体现了( )
A.Fe2+具有酸性,维生素C具有碱性
B.Fe2+具有还原性,维生素C也具有还原性
C.Fe2+具有氧化性,维生素C具有还原性
D.Fe2+具有碱性,维生素C具有酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:①C(s)+H2O(g)═CO(g)+H2(g) △H=+131.3kJ·mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g) △H=+41.3kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为。该反应在(填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20min内,N2的平均反应速率v(N2)=。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是填字母序号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol·L-1 , 在该条件下达到平衡时,CO的转化率为。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
(1)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(2)I2(s)+H2(g)![]() 2HI(g) ΔH="+26.48" kJ·mol-1
2HI(g) ΔH="+26.48" kJ·mol-1
下列判断正确的是( )
A. 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(1)的产物比反应(2)的产物稳定
D. 反应(2)的反应物的总能量比反应(1)的反应物的总能量低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com