
科目: 来源: 题型:
【题目】常温下,将1.0mol/L 盐酸滴入20mL 10mol/L氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示。下列有关说法正确的是
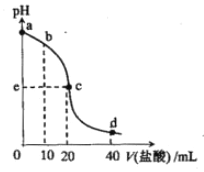
A. a点,c(NH4+)=c(OH-)
B. b点,c(NH4+)>c(Cl-)>c(NH3·H2O)
C. c点,pH=7
D. d点,c(NH4+)+c(NH3·H2O)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】浓硫酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M
①氧化剂是H3AsO3;②还原性:Cl->As;
③每生成7.5gAs,还原剂失去的电子为0.3 mol;
④M为OH-;⑤ SnCl62-是氧化产物。
关于该反应的说法中正确的组合是( )
A.①③⑤
B.①③
C.①②④⑤
D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】向盛有少量CuCl2溶液的试管中滴入少量NaOH溶液,再滴入适量浓氨水,下列叙述不正确的是( )
A. 开始生成蓝色沉淀,加入过量氨水时,形成无色溶液
B. 开始生成Cu(OH)2,它不溶于水,但溶于浓氨水,生成深蓝色溶液
C. 开始生成蓝色沉淀,加入氨水后,沉淀溶解生成深蓝色溶液
D. 开始生成Cu(OH)2,之后生成更稳定的配合物
查看答案和解析>>
科目: 来源: 题型:
【题目】增强铝的耐腐蚀性,现以铅蓄电池以外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使表面表面的氧化膜增厚。反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(I)
电解池:2Al+3H2O ![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=![]() ,它所对应的化学反应为:__________________。
,它所对应的化学反应为:__________________。
(2)已知在一定温度下,
①C(s)+CO2(g)![]() 2CO(g) ΔH1=a kJ/mol 平衡常数K1;
2CO(g) ΔH1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)![]() CO(g)+H2(g) ΔH3 平衡常数K3。
CO(g)+H2(g) ΔH3 平衡常数K3。
则K1、K2、K3之间的关系是________,ΔH3=__________________(用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是______反应(填“吸热”或“放热”),若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为________。
(4)高炉炼铁产生的废气中的![]() 可进行回收,使其在一定条件下和
可进行回收,使其在一定条件下和![]() 反应制备甲醇:
反应制备甲醇: ![]() 。请回答下列问题;
。请回答下列问题;
①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 |
| 能量变化( |
甲 | 1 |
|
| 放出 |
乙 | 1 |
|
| 放出 |
丙 | 2 |
|
| 放出 |
则下列关系正确的是__________。
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
e.该反应若生成1![]()
![]() ,则放出(
,则放出(![]() 热量
热量
②若在一体积可变的密闭容器中充入1![]()
![]() 、2
、2![]()
![]() 和1
和1![]()
![]() ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知40℃时水的离子积常数为Kw。该温度下, 将浓度为 a mol/L的一元酸HA与 b mol/L的一元碱BOH等体积混合,该溶液呈中性时,下列叙述不正确的是
A. a=b,pH=7
B. 混合溶液的c(H+)=c(OH-)
C. 混合溶液中,c(B+) =c(A-)
D. 混合溶液中,c(OH-)= ![]() mol/L
mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程。已知键能数据如下表:
化学键 | N≡N | N—H | H—H |
键能(kJ/mol) | 942 | 391 | b |
反应N2(g)+3H2(g) ![]() 2NH3(g);△H=-93kJ·mol-1。试根据表中所列键能数据计算b数值:( )
2NH3(g);△H=-93kJ·mol-1。试根据表中所列键能数据计算b数值:( )
A.551
B.437
C.558
D.160
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com