
科目: 来源: 题型:
【题目】清远市某校的化学兴趣小组经常做探究实验:
(一)为了探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):

查阅资料所知:①2NO+Na2O22NaNO2
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3- 。
回答下列问题:
(1)仪器a名称:________。
(2)B瓶内装的物质是:____。
(3)若NO能被Na2O2完全吸收,E装置中的现象为___________________________。
(4)三颈烧瓶A中反应的化学方程式为_____________________________。
(5)C装置的作用是_____________________________________。
(二)实验室常用Na2SO3固体与浓硫酸反应制取SO2
(6)现有已制得SO2的饱和溶液,请设计一个简单实验,比较SO2与Fe2+ 还原性的
强弱(可供选择的试剂有:SO2的饱和溶液、FeCl2溶液、氯水、FeCl3溶液、KSCN
溶液、Ba(NO3)2溶液、BaCl2溶液)【要求:简要写出实验步骤、现象和结论】_________________________________________________________________。
(7)某同学测定部分变质的Na2SO3样品样品中Na2SO3的含量(已知在酸性条件下IO3-能将SO32-氧化为SO42-,自身还原为I-):
①用电子天平称取16.00g Na2SO3固体配成l00 mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000 mol L-1酸性KIO3溶液(硫酸酸化)滴定,三次平行实验测得标准液的体积为24.00mL。则滴定终点时锥形瓶中产生的现象为________________________,写出与产生终点现象有关反应的离子方程式________________________________,样品中Na2SO3的质量分数为_________。(计算结果保留四位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】离子晶体熔点的高低决定于阴、阳离子之间距离、晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是( )
A. KCl>NaCl>BaO>CaO B. NaCl>KCl>CaO>BaO
C. CaO>BaO>KCl>NaCl D. CaO>BaO>NaCl>KCl
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
①钠在空气中燃烧生成白色的氧化钠 ②钠投入硫酸铜溶液中有红色粉末产生 ③过氧化钠可在呼吸面具中做供氧剂 ④铁丝在氯气中燃烧生成棕黄色的FeCl3 ⑤钠、氢气在氯气中燃烧都能产生白烟
A.①②B.②③C.③④D.④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度是________。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】查阅医学资料,得知扁桃酸衍生物是重要的医药中间体,工业合成扁桃酸衍生物D路线如下:
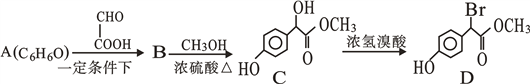
(1)A的结构式:_____。
(2)B含的官能团名称:_________ 。
(3) 写B生成C的化学方程式____________________________。
(4) C→D的反应类型是__________,1 mol D在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为_________mol。
(5)写出乙醛与A在一定条件下发生缩聚反应的化学方程式______________________(不要求指明反应条件)。
(6)同时符合下列条件的D的所有同分异构体(不考虑立体异构)有____种;
①能与NaHCO3溶液反应产生气体;
②苯环上只有2个取代基;
③遇氯化铁溶液发生显色反应。其中核磁共振氢谱显示为5组峰,且峰面积比为3:1:2:2:1的同分异构体是__________________(写结构简式)。
(7)已知: ,请设计合成路线以A和C2H2为原料合成
,请设计合成路线以A和C2H2为原料合成![]() (无机试剂任选):________________________。
(无机试剂任选):________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳和硫的化合物在生产生活中的应用非常广泛。
(1)用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566.0 kJ·mol-1
2CO2(g) ΔH2=-566.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
则2H2(g)+SO2(g)![]() S(g)+2H2O(g) ΔH4=__________。
S(g)+2H2O(g) ΔH4=__________。
(2)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
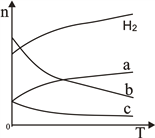
①该反应为____反应(填“吸热”或“放热”)。
②曲线c表示的物质为____________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________【要求答2条】。
④恒温恒容下,能够说明该反应已达到平衡的是_______(填序号);
A.容器内的压强不发生变化
B.混合气体的密度不发生变化
C.n(CO2):n(H2):n(C2H4):n(H2O)=2:6:1:4
D.单位时间内生成6molH2,同时生成4 molH2O
(3)欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________________。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液液呈中性,则氨水的电离平衡常数Kb=______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】和硅同一主族的锗也是重要的半导体材料,锗应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:

已知:①“碱浸”过程中的反应为:GeO2+2NaOH=Na2GeO3+H2O、As2O3+2NaOH=2NaAsO2+H2O
② GeCl4的熔点为-49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃。
(1)砷的原子序数为33,砷在元素周期表中的位置为第______周期第________族。
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,其反应的离子方程式为:___________________________________________________________________。
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是_________________。
(4)“蒸馏”过程中的反应的化学方程式为:________________________________。
(5)“水解”操作时保持较低温度有利于提高产率,其最可能的原因是_____________(答一条即可)。
(6)若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的较纯二氧化锗产品,则杂质脱除率为_________。
(7)和砷同一主族的锑也可以用于半导体中。一种突破传统电池设计理念的镁—锑液态金属二次电池工作原理如图所示:

该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,C1-向______(填“上”或“下”)移动;放电时,正极的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】要除去下列各组物质中的少量杂质,所选试剂和方法可行的是( )
选 项 | 物 质 | 杂 质 | 试剂、方法 |
A | CO2气体 | HCl气体 | 通过NaOH溶液,洗气 |
B | 铜粉 | 镁粉 | 硫酸,过滤 |
C | FeCl2溶液 | ZnCl2 | 加入适量铁粉,过滤 |
D | MnO2 | KMnO4 | 加 热 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】利用反应Zn + CuSO4 ═ Cu + ZnSO4 设计一个原电池。
(1) 在下面方格内画出实验装置图________.

(2)指出正极材料可以为_____________, 电极反应式是_______________;负极材料为_____________,电极反应式是_____________________________.
(3)若反应过程中有0.2mol电子通过,则溶解Zn的质量为________g.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铍的原子序数为4,下列对铍及其化合物的叙述中,正确的是( )
A.铍的金属性比钠强
B.氯化铍的氧化性比氯化锂弱
C.氢氧化铍的碱性比氢氧化钙弱
D.单质铍易跟冷水反应生成H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com