
科目: 来源: 题型:
【题目】氮及其化合物存在如下转化关系:
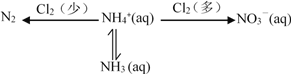
(1)在氨氮废水中通入一定量的氯气,利用产生的HClO可除去废水中含有的游离氨或铵盐。
已知 NH4+ + HClO ![]() NH2Cl + H+ + H2O H = a kJmol-1
NH2Cl + H+ + H2O H = a kJmol-1
2NH2Cl + HClO ![]() N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
则 2NH4+ + 3HClO ![]() N2 + 3H2O + 5H+ + 3Cl- H =______kJmol-1
N2 + 3H2O + 5H+ + 3Cl- H =______kJmol-1
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟。
① 电解时,阳极的电极反应式为________。
② 电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示。

图1 Cl-浓度对氨氮去除速率、能耗的影响 图2初始pH对氨氮去除速率、能耗的影响
图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是________;图2中,pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是________。
③ 当溶液中Cl-浓度较高时,测得溶液中的NO![]() 浓度会随之增大,可能的原因是________。
浓度会随之增大,可能的原因是________。
(3)某工厂将含NH4+废水的去除与工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分)的去除结合起来,设计了如下方案:
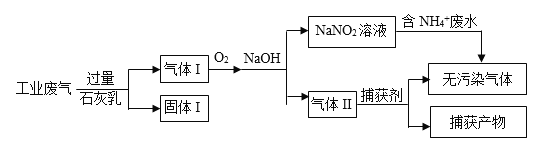
① 固体I的成分为________。
② 为使100L 150 mg/L(浓度均以氮原子计,下同)的含NH4+ 废水达到国家二级排放标准10mg/L,图中通入的氧气在标准状况下的体积至少为________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组探究过量甲醛与新制氢氧化铜的反应,探究过程如下:
(一)提出猜想
(1)甲同学通过查阅资料,提出猜想1和猜想2。
猜想1:HCHO + Cu(OH)2![]() Cu + CO↑+ 2H2O
Cu + CO↑+ 2H2O
猜想2:HCHO + 4Cu(OH)2 + 2NaOH![]() 2Cu2O + Na2CO3 + 6H2O
2Cu2O + Na2CO3 + 6H2O
猜想1和猜想2均体现了甲醛的________性。
(2)乙同学类比乙醛与新制氢氧化铜的反应,提出猜想3。
用化学方程式表示猜想3:________。
(二)进行实验,收集证据
已知:可用银氨溶液检测CO,反应为CO + 2Ag(NH3)2OH ![]() 2Ag↓+ (NH4)2CO3 + 2NH3。实验在如下装置中进行。反应结束后,A中生成紫红色固体沉淀物,C中银氨溶液无明显变化,气囊略鼓起。
2Ag↓+ (NH4)2CO3 + 2NH3。实验在如下装置中进行。反应结束后,A中生成紫红色固体沉淀物,C中银氨溶液无明显变化,气囊略鼓起。
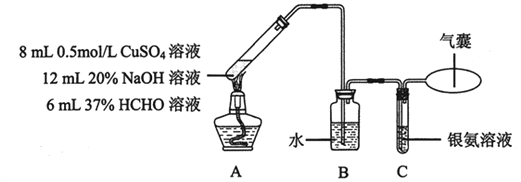
(3)配制银氨溶液所需的试剂是________。
(4)装置B中水的作用是________。
(5)甲同学取A中反应后溶液加入到足量稀盐酸中,无明显现象。乙同学另取该溶液加入到BaCl2溶液中,产生大量白色沉淀。
实验方案明显不合理的是________(填“甲”或“乙”),理由是________。
(6)已知Cu2O![]() Cu + CuSO4。
Cu + CuSO4。
丙同学通过实验证明生成的紫红色固体沉淀物是Cu,其实验方案为________。
(三)得出结论
(7)写出过量甲醛与新制氢氧化铜可能发生反应的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应A(g)+2B(g)![]() 2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
(1)升高温度,B的转化率___________,v(正)__________。
(2)使用催化剂,A的物质的量___________。
(3)增大压强,v(逆)___________,C的产率___________。
(4)增大A的浓度,则B的转化率____________,C的物质的量_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式如下所示,它在一定条件下可能发生的反应有( )

①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A. ②③④ B. ①③④⑤⑥
C. ①③④⑤ D. ①③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除去杂质的方法正确的是
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3 | Na2CO3 | ---- | 灼烧 |
B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
C | KBr溶液 | Br2 | KOH溶液 | 分液 |
D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用蚀刻液浸泡铜板可制备印刷电路板,产生的蚀刻废液需要回收利用。
(1)应用传统蚀刻液(HCl-FeCl3)
①蚀刻铜板主要反应的离子方程式为________。
②该蚀刻液中加入一定量盐酸的目的为________,同时提高蚀刻速率。
③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+2Fe3+ ![]() 3Fe2+、Fe+Cu2+
3Fe2+、Fe+Cu2+ ![]() Fe2++Cu,还有________、________。(用离子方程式表示)。
Fe2++Cu,还有________、________。(用离子方程式表示)。
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:
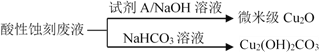
①蚀刻铜板主要反应的离子方程式为________。
②回收微米级Cu2O过程中,加入的试剂A是______(填字母)。
a.Fe粉 b.葡萄糖 c. NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是________。
(3)应用碱性蚀刻液(NH3H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。蚀刻铜板主要反应的化学方程式为________。
(4)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO),进一步反应实现蚀刻液再生,结合化学用语解释CuCl2蚀刻液再生的原理________。
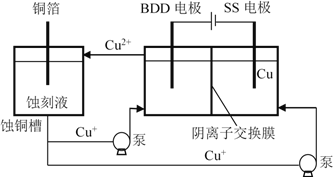
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度为T时,向2.0 L恒容密闭容器中充入1.0 molA和1.0 molB,发生反应A(g)+B(g)![]() C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A)=____________。
(2)温度为T时,达到平衡后B物质的量的浓度=________。
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH_______(填“>0”或“<0”)。
(4)下列措施能增大反应速率,且平衡向正反应方向移动是__________。
a.及时分离出A气体 b.适当升高温度
c.增大B的浓度 d.选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】认识反应条件对化学反应的影响,对学好化学具有重要意义。下列说法中正确的是
A.硫在空气中或纯氧中燃烧,主要产物都是SO2
B.钠在空气中缓慢氧化或在空气中燃烧,产物都是Na2O2
C.铁片在常温下与稀硫酸或浓硫酸反应,都生成FeSO4
D.镁在空气中或纯氧中燃烧,产物都只有MgO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com