
科目: 来源: 题型:
【题目】钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。
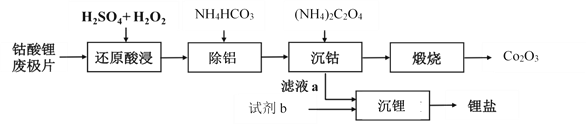
(1) “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□ ![]() □CoSO4+□ +□ + □ 。__________
□CoSO4+□ +□ + □ 。__________
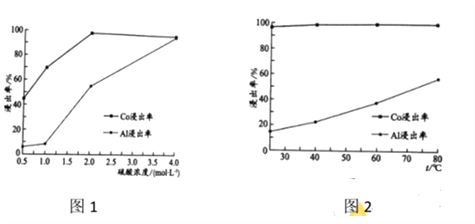
(2) “还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是________。
A. Co的浸出率较高 B. Co和Al浸出的速率较快
C. Al的浸出率较高 D. 双氧水较易分解
(3)加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:________。
(4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为________(小数点后保留两位)。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。
温度 | Li2SO4 | Li2CO3 |
0 oC | 36.1 g | 1.33 g |
100 oC | 24.0 g | 0.72 g |
结合数据分析,沉锂过程所用的试剂b是________(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,________,洗涤干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
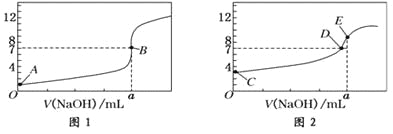
以HA表示酸,下列说法正确的是( )
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C. 达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D. 当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示物质结构的化学用语或说法中,正确的是( )
A. 氮气分子的电子式是:N::N:
B. 苯的结构简式是C6H6
C. 中子数为18的氯原子符号是18Cl
D. 用电子式表示NaCl的形成过程是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去。
查阅资料可知:
①在酸性环境下,Cr(VI)通常以Cr2O72-的形式存在,Cr2O72-+H2O ![]() 2CrO42-+2H+
2CrO42-+2H+
②Cr2O72-的氧化能力强于CrO42-
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的pH | 1.9 | 7.0 | 4.3 |
沉淀完全的pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(VI)。下列关于焦炭的说法正确的是________(填字母序号)。
a. 作原电池的正极 b. 在反应中作还原剂 c. 表面可能有气泡产生
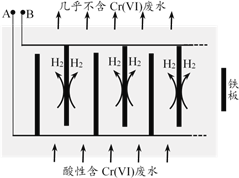
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如右图所示。
(2)A极连接电源的________极,A极上的电极反应式是________。
(3)电解开始时,B极上主要发生的电极反应为2H++2e-=H2↑,此外还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为________。
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中Cr元素去除率的关系如右图所示。

①由图知,电解还原法应采取的最佳pH范围为________。
a. 2 ~ 4 b. 4 ~ 6 c. 6 ~ 10
②解释曲线I和曲线IV去除率低的原因:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】分子式为C7H16、C5H11Cl、C5H10(链状,不考虑空间构型)的同分异构体的数目分别有( )种
A. 9,8,5 B. 8,9,5 C. 9,9,6 D. 8,8,6
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是

A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com