
科目: 来源: 题型:
【题目】已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625 kJ·g-1。下列热化学方程式中不正确的是( )
A.CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH =-890 kJ/mol
B.![]() CH4(g)+O2(g)
CH4(g)+O2(g)![]() CO2(g)+H2O(l) ΔH=-445 kJ/mol
CO2(g)+H2O(l) ΔH=-445 kJ/mol
C.![]() CO2(g)+H2O(l)
CO2(g)+H2O(l)![]() CH4(g)+O2(g) ΔH=+445 kJ/mol
CH4(g)+O2(g) ΔH=+445 kJ/mol
D.CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-55.625 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 向饱和NaCl溶液中1:1通入NH3和CO2制备NaHCO3
B. 500℃左右比通常状况下更有利于合成氨
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。下列说法中,错误的是( )
A. ![]() In是In元素的一种核素 B.
In是In元素的一种核素 B. ![]() In原子核内有49个中子
In原子核内有49个中子
C. ![]() In原子核内质子数和中子数之和为115 D.
In原子核内质子数和中子数之和为115 D. ![]() In原子核外有49个电子
In原子核外有49个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度条件下,N2与H2反应生成NH3的过程中能量变化曲线如下图。
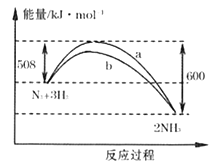
(1)曲线_______(填“a“或“b”")是加入催化剂时的能量变化曲线, N≡N键能为946kJ/mol,N-H键能为391kJ/mol,则H-H建能为_______kJ/mol。
(2)水的自偶电离方程式为2H2O![]() H3O++OH-,液氨也能发生自偶电离,写出液氨的自偶电离方程反应过程式_________;NH2-电子式为________。
H3O++OH-,液氨也能发生自偶电离,写出液氨的自偶电离方程反应过程式_________;NH2-电子式为________。
(3)次氯酸钠溶液中离子浓度由大到小顺序为________;将氨气通入到次氯酸钠溶液中可制得联氨(N2H4),写出反应的离子方程式__________;用四氧化二氮作助燃剂,联氨可作火箭燃料。已知:N2(g)+2O2(g)= 2NO2(g),ΔH,= +67.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol;N2O4(g)=2NO2(g),ΔH3=+ 57kJ/mol,写出气态的联氨在四氧化二氮气体中燃烧生成两种无污染气态产物的热化学方程式______。
(4)将2.04mol/L的氨水与0.02mo/L的硝酸银溶液等体积混合得到混合溶液,混合体系中存在平衡:Ag+(aq) +2NH3·H2O(aq) ![]() Ag(NH3)2+(aq)+2H2O(1),平衡常数表达式K=_________;在常温时K=1×107,由于氨水过量,银离子几乎反应完全,计算此时混合溶液中c(Ag+)=_________mol/ L。
Ag(NH3)2+(aq)+2H2O(1),平衡常数表达式K=_________;在常温时K=1×107,由于氨水过量,银离子几乎反应完全,计算此时混合溶液中c(Ag+)=_________mol/ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A.元素周期表中,第ⅠA族元素和第ⅦA族元素的原子之间只能形成离子键
B.所有化学物质内部都存在化学键
C.CO2和SiO2的物理性质相差很大,但含有相同类型的化学键
D.HF的热稳定性很好,是因为HF分子间存在着较强的作用
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是周期表中的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的元素是__________。
(2)最高价氧化物的水化物碱性最强的元素是__________。
(3)可用于制半导体材料的元素是_______。
(4)表中元素,只有负价没有正价的元素是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘化亚铜(CuI)是阳极射线管复盖物,也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(杂质中含有少量铁)制取无水碘化亚铜的流程。

(1)过程①得到的溶液呈蓝色,其原因是______(用化学方程式表示),当温度高于40℃时,过程①反应速率减慢,原因是________________。
(2)过程②调节溶液pH适宜选用的试剂是_______(填正确答案的字母编号);已知25℃时,Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=4×10-35,lg2=0.30,则过程②调节溶液PH时,溶液的PH不小于________。
A.NaOH B.NH3·H2O C.CuO D.CuCO3
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为________________。
(4)过程④用乙醇洗涤沉淀的目的为________________。
(5)准确称取mg CuI样品,加入足量的Fe2(SO4)3溶液中,CuI被完全氧化生成Cu2+和I2。待样品完全反应后,用amol/L酸性KMnO4溶液滴定,达到终点时,消耗酸性KMnO4溶液的体积平均值为VmL。则样品中CuI的质量分数为_______(已知: 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 由原子构成的晶体不一定是原子晶体 B. 分子晶体中的分子内不含有共价键
C. 分子晶体中一定有非极性共价键 D. 分子晶体中分子一定紧密堆积
查看答案和解析>>
科目: 来源: 题型:
【题目】资料显示:锌与浓硫酸共热除生成二氧化硫气体外,还可能产生氢气;在加热的条件下二氧化硫可被CuO氧化。为验证该反应的气体产物及性质,设计了如下图所示的实验装置(设锌与浓硫酸共热时产生的气体为X)。
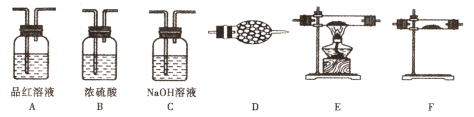
(1)上述装置的连接顺序为:气体X→A→____→A→ → → →D;
(2)反应开始后,观察到第一个装置A中的品红溶液褪色,实验结束后取适量该溶液于试管中并加热,现象为_______________________________________;
(3)装置 C中的NaOH溶液能用下列____代替;
a.酸性KMnO4溶液 b.CaCl2溶液 c.饱和NaHSO3溶液
装置D的作用是____________________________
(4)气体X中可能含有H2的原因是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com