
科目: 来源: 题型:
【题目】某小组同学进行实验研究FeCl3溶液和Na2S溶液的反应。
【实验一】

已知:FeS、Fe2S3均为黑色固体,均能溶于盐酸。H2S气体有臭鸡蛋气味。
同学们对黑色沉淀的成分提出两种假设:
ⅰ.Fe3+与S2反应直接生成沉淀Fe2S3。ⅱ.Fe3+被S2还原,生成沉淀FeS和S。
甲同学进行如下实验:
操作 | 现象 |
取少量FeS固体,加入稀盐酸 | 固体溶解,有臭鸡蛋气味气体生成 |
取少量Fe2S3固体,加入稀盐酸 | 固体溶解,出现淡黄色浑浊,有臭鸡蛋气味气体生成 |
根据上述实验现象和资料,甲得出结论:黑色沉淀是Fe2S3。
(1)0.1 mol·L 1 Na2S溶液的pH为12.5。用离子方程式表示其显碱性的原因:_______。
(2)乙认为甲的结论不严谨,理由是________。
(3)进一步研究证实,黑色沉淀的主要成分是Fe2S3。Na2S溶液呈碱性,FeCl3溶液与其反应不生成Fe(OH)3而生成Fe2S3的可能原因是________。
【实验二】
步骤 | 操作 | 现象 |
I |
| 开始时,局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失,同时溶液中产生淡黄色浑浊和臭鸡蛋气味的气体 |
II | 继续滴加Na2S溶液 | 一段时间后,产生大量的黑色沉淀,振荡,沉淀不消失 |
(4)进一步实验证实,步骤 I 中局部产生少量的黑色沉淀是Fe2S3,黑色沉淀溶解的主要原因不是Fe2S3与溶液中Fe3+发生氧化还原反应。步骤 I 中黑色沉淀溶解的反应的离子方程式是________。
(5)根据以上研究,FeCl3溶液和Na2S溶液反应的产物与________相关。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.在恒温、体积为1.0L的密闭容器中通入1.0molN2和xmolH2发生如下反应N2(g)+3H2(g)![]() 2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
(1)20min内,V(N2)=______。
(2)该反应的热化学方程式为____________。
(3)下列叙述中能表示该反应达到平衡状态的是_______(填序号)。
①N2体积分数保持不变
②单位时间断裂03tmolH-H键,同时生成0.6molN-H键
③混合气体的密度不再改变
④2v正(H2)=3v逆(NH3)
⑤混合气体的平均摩尔质量不再改变
II.1883年,瑞典化学家阿伦尼乌斯创立了电离学说,在水溶液范围内对酸、碱作出了严密的概括。请回答下列有关水溶液的问题:
(4)①用电离方程式表示氨水溶液是碱性的原因________;
②用离子方程式表示碳酸钠溶液显碱性的原因__________。
(5)25℃时,在含HA和A-的溶液中,HA和A-两者中各自所占的物质的量分数(a)随溶液pH变化的关系如下图所示。请比较下列大小关系(填编号)
①在pH<4.76的溶液中,c(A-)____(HA);
②在pH>4.76的溶波中,c(A-)+(OH-)_____c(H+)。
A.大于 B.小于 C.等于 D.可能大于,也可能等于 E.可能小于,也可能等于

查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
【答案】C
【解析】由电荷守恒可知c(NH4+)+c(H+)=2c(SO42-)+c(OH-),当pH=7时,c(NH4+)=2c(SO42-),故A项错;醋酸是弱酸,浓度越大,电离程度越小,当两溶液pH相差1时,c1≠10c2,B项错;pH=11的NaOH与pH=3的醋酸等体积混合后溶液显酸性,滴入石蕊试液呈红色,C项对;氨水存在电离平衡:NH3·H2ONH4++OH-,加(NH4)2SO4固体,平衡左移,导致 减小,D项错。
减小,D项错。
【题型】单选题
【结束】
20
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.  <1.0×10-7mo1/L
<1.0×10-7mo1/L
B. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-)
D. c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】M是合成抗生素灰黄霉素的中间产物,其合成路线如下:

已知:
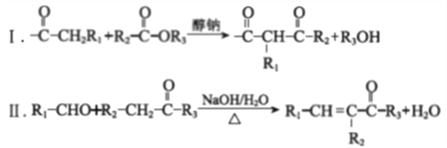
(R1、R2、R3代表烃基或氢原子)
(1)A中含有的官能团的名称为醚键、氯原子、________、________。
(2)A→C反应的化学方程式是________。
(3)C→D的反应类型是________。
(4)E的结构简式是________。
(5)I的核磁共振氢谱中只有一个吸收峰。
①条件a是________。
②H→I反应的化学方程式是________。
③I→K反应的化学方程式是________。
(6)L的结构简式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸乙酯是应用非常广泛的有机溶剂,主要用于涂料、油墨、粘合剂、胶片、医药、化工、电子、化妆品及食品行业等。实验室可用乙酸与乙醇反应制备乙酸乙酯。
(1)为判断乙酸乙酯中与乙基(-CH2CH3)相连的氧原子的来源,请没计一种可进行判别的方案__________。(无需给出实验装置实验步骤,只需给出设计思想)。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用下图所示装置进行以下四个实验,实验结束后充分振荡试管II再测有机层的厚度,实验记录如下:
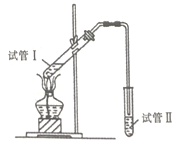
编号 | 试管I中的试剂 | 有机层厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18mol/L浓硫酸 | 3.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①试管II中试剂的名称为_______,其作用是__________。
②分析比较实验_____(填实验编号)的数据,可推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
③分析比较实验C、D,证明对酯化反应具有催化作用的是H+。实验D中应加入盐酸的体积和浓度分别是_______mL和_____mol/L。
(3)现代化工生产探索以CH3CHO为原料,用(CH3CH2O)3Al作催化剂,合成乙酸乙酯:2CH3CHO![]() CH3COOCH2CH3
CH3COOCH2CH3
在实验室中进行该实验时,不同条件下的实验结果如下表所示:
实验序号 | 催化剂用量/g | 反应温度/℃ | 反应时间/h | 副产物/% | 选择性/% | 转化率/% |
1 | 0.368 | 6.5-2 | 52 | 0.35 | 99.9 | 99.6 |
2 | 0.278 | 10-0.5 | 52 | 0.12 | 99.81 | 95.39 |
3 | 0.368 | 6.5-2 | 12 | 0.1 | 99.8 | 99.7 |
4 | 0.368 | 10-0.5 | 52 | 0.8 | 99.5 | 97.3 |
(注)选择性:转化的CH3CHO中生成CH3COOCH2CH3的百分比。
下列说法正确的是_______(填编号)。
A.用乙醛合成乙酸乙酯,可减少“工业三废”的排放
B.温度越高反应速率越快,乙醛的转化率越高
C.用乙醛合成乙酸乙酯的反应时间控制在12h为宜
D.催化剂用量不会影响合成反应的选择性转化率
E.(CH3CH2O)3Al是乙醛制乙酸乙酯的高效催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中水既不是氧化剂,又不是还原剂的氧化还原反应是( )
A.SO3+H2O=H2SO4
B.2Na2O2+2H2O=4NaOH+O2↑
C.2F2+2H2O=4HF+O2
D.NaH+H2O=NaOH+H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH) 、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡。
Ⅱ.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a [主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b。
Ⅳ.Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400 ℃~600 ℃煅烧,即得到Co2O3。
请回答:
(1)Ⅰ中,稀硫酸溶解CoCO3的化学方程式是________,加入Na2SO3溶液的主要作用是________。
(2)根据图1、图2分析:

①矿石粉末浸泡的适宜条件应是________。
②图2中铜、钴浸出率下降的可能原因是________。
(3)Ⅱ中,浸出液中的金属离子与NaClO3反应的离子方程式:ClO3 + + == Cl + + __________ ,________________
(4)Ⅱ中,检验铁元素完全除去的试剂是________,实验现象是________。
(5)Ⅱ、Ⅳ中,加入Na2CO3 的作用分别是________、________。
(6)Ⅲ中,沉淀b的成分是MgF2 、________(填化学式)。
(7)Ⅴ中,分离出纯净的CoC2O4·2H2O的操作是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是_______。
a.单质的熔点降低
b.原子半径和简单离子半径均减小
c.元素的金属性减弱,非金属性增强
d.氧化物对应的水化物碱性减弱,酸性增强
(2)氧化性最弱的简单阳离子是_______;热稳定性:H2O____H2S(填>、<、=)。
(3)写出SiCl4的电子式:________。
(4)已知化合物M由第三周期的两种相邻元素按原子个数比1:1组成,不稳定,遇水反应生成谈黄色沉淀A和两种无色有刺意性气味气体B、C,相应物质的转化关系如图:

①已知M的摩尔质量为135g/mol,写出M的化学式_____。
②任选一种合适的氧化剂Y,写出C的浓溶液与Y反应生成D的离子反应方程式_______。
③M中的一种元素可形成化合物KXO3,可用于实验室制O2。若不加催化剂,400℃时KXO3分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】分子晶体具有某些特征的本质原因是( )
A. 组成晶体的基本粒子是分子 B. 熔融时不导电
C. 晶体内微粒间以分子间作用力相结合 D. 熔点一般比原子晶体低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com