
科目: 来源: 题型:
【题目】25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是
A. 1.0×10-2molL-1 B. 1.0×10-7molL-1
C. 1.0×10-12molL-1 D. 1.0×10-14molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应生成的羟基自由基(·OH) 能氧化降解有机污染物。下列说法正确的是

A. 电源的X极为正极
B. 与电源Y相连电极的电极反应式为H2O+e-=H++·OH
C. Fenton反应: H2O2+Fe2+=Fe(OH)2++·OH
D. 每消耗22.4L O2 (标准状况),整个电解池中理论上可产生2mol·OH
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A. ![]() <1.0×10-7mol/L
<1.0×10-7mol/L
B. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)
D. c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
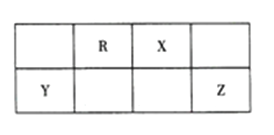
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸⑤能透过半透膜 ⑥加入CuCl2,会析出沉淀 ⑦带正电荷
A.①④⑥B.②③④C.②③⑤D.②③④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,根据要求回答下列问题。

(1)十种元素中化学性质最不活泼的元素是________(填元素符号)。
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是________(填化学式)。
(3)I元素跟A元素形成化合物的电子式是_____________。
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 25 ℃时,向0.1 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH)>c(SO![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
B. 25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol·L-1
C. 0.1![]()
![]() 溶液:
溶液:![]()
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________。
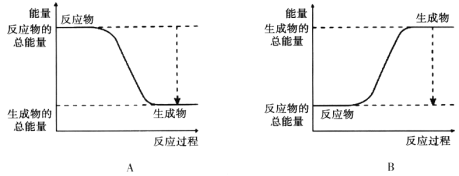
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
请填写下表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) | |
拆开化学键 | 2molH2化学键 | ________ | ________ |
1molO2化学键 | |||
形成化学键 | 4molH-O键 | ________ | ________ |
总能量变化 | ________ | ________ | |
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______极发生_______反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,0.1 mol/L的某一元酸HA溶液中![]() 。下列说法正确的是
。下列说法正确的是
A. 25℃时,0.1 mol/L的HA溶液pH=4
B. 将pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH一)>c(H+)
C. 将浓度均为0.1 mol/L的HA和NaA溶液等体积混合,若所得溶液呈酸性,则: c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D. 10mL0.2mol/L HA溶液与10mL 0.1 mol/L NaOH溶液混合后,所得20mL溶液中:c(H+)﹢c(HA)﹣c(OH-)=0.05 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com