
科目: 来源: 题型:
【题目】氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如下图所示,下列叙述不正确的是
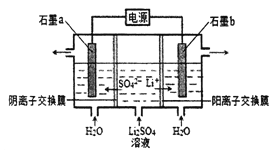
A. b极附近溶液的pH增大
B. a极反应为2H2O-4e-= O2↑+4H+
C. 该法制备LiOH还可得到硫酸和H2
D. 当电路中通过1mol 电子时,有2mol LiOH生成
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
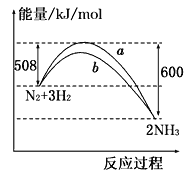
A. 该反应的热化学方程式为:N2 + 3H2 ![]() 2NH3, △H = -92kJ·mol-1
2NH3, △H = -92kJ·mol-1
B. 在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为92kJ
C. b曲线是加入催化剂时的能量变化曲线
D. 加入催化剂, 该化学反应的ΔH不改变
查看答案和解析>>
科目: 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)=CO(g) + H2(g) ΔH1 = a kJmol-1
②CO(g) + H2O(g)=CO2 (g) + H2 (g) ΔH2 = b kJmol-1
③CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) ΔH3= c kJmol-1
④2CH3OH(g)=CH3OCH3(g) + H2O(g) ΔH4= d kJmol-1
A. 反应①、②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)![]() 1/2 CH3OCH3 (g) +1/2H2O(l)的ΔH=d/2kJ·mol1
1/2 CH3OCH3 (g) +1/2H2O(l)的ΔH=d/2kJ·mol1
D. 反应 2CO(g) + 4H2 (g)![]() CH3OCH3 (g) + H2O(g)的ΔH= ( 2b+ 2c+d)
CH3OCH3 (g) + H2O(g)的ΔH= ( 2b+ 2c+d)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离的是( )
A.Na+、OH﹣、SO42﹣
B.H+、Cl﹣、SO42﹣
C.Na+、K+、OH﹣
D.Na+、K+、NO3﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】俗话说“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程。请回答下列问题:

(1)在试管甲中需加入浓硫酸、冰醋酸各2 mL,乙醇3 mL,加入试剂的正确的操作是__________。
(2)浓硫酸的作用:①__________,②__________。
(3)试管乙中盛装的饱和碳酸钠溶液的主要作用是__________。
(4)装置中通蒸气的导管只能通到饱和碳酸钠溶液的液面上,不能插入溶液中,目的是__________,长导管的作用是__________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是__________。
(6)进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是__________。
(7)试管乙中观察到的现象是__________,由此可见,乙酸乙酯的密度比水的密度__________(填“大”或“小”),而且__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】规律提炼题组
完成下列与溶液pH有关的计算,并提炼解题规律。
(1)室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为_______
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为 _____
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合:,
①若所得混合溶液为中性,则a:b= ____
②若所得混合溶液pH=3,则a:b=_____
(4)已知某温度时0.1 molL-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________(用含a、b的表达式表示)
(5)(学法题)总结归纳求混合溶液pH时,应注意的问题:__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
科目: 来源: 题型:
【题目】硫氰酸盐、苯酚及硫代硫酸盐是HPF脱硫废液中的主要污染物(其中还含有Cl-、SO![]() 、Na+等),可用NaClO3、H2SO4作脱除的试剂。
、Na+等),可用NaClO3、H2SO4作脱除的试剂。
(1)Cl2与热的NaOH溶液反应生成NaClO3,该反应的化学方程式为____________________________。
(2) 常温时,反应C6H5O-+H2O ![]() C6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。
C6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。
(3)处理该废水需经预处理和再处理阶段。
①用浓硫酸对600 mL HPF脱硫废液进行酸化预处理(反应温度100℃),其结果如表1所示:
表1 预处理前后三种离子浓度变化情况
项目 | S2O | SCN-(g·L-1) | 苯酚(g·L-1) | pH |
处理前 | 34.28 | 70.11 | 1.3 | 8.55 |
处理后 | 0.91 | 69.76 | 1.35 | 2.4 |
由表1可知,该处理过程中主要被除去的污染物是________。
②对预处理后废液进行再处理(反应温度100 ℃)时,13次依次向废液中加入试剂情况如表2所示:
表2 13次依次加入试剂情况
次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
NaClO3/g | 16.3 | 0 | 0 | 0 | 0 | 0 | 7.6 | 0 | 5.7 | 0 | 10.9 | 0 | 7.1 |
浓H2SO4/mL | 0 | 2 | 2 | 2 | 4 | 4 | 0 | 4 | 0 | 4 | 0 | 4 | 0 |
实验结果如图1所示:

前6次苯酚脱除率可达到80%左右,该过程中苯酚转化为白色沉淀(含苯环),这与溶液中ClO![]() 和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为______________。
和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为______________。
③由表2和图1中数据得出,第7~13次操作中SCN-在较强酸性条件下被ClO![]() (不水解)氧化的依据是________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:________。
(不水解)氧化的依据是________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】易混易错题组
物质在水中可能存在电离平衡、盐类的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1 molL-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________________________________________________。
(2)B为0.1 molL-1 NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(共3个,分别用离子方程式表示):_____________________________________________
(3)C为Al2(SO4)3溶液,实验室中配制Al2(SO4)3溶液时通常需要向其中加入_______________,若把B和C溶液混合,将产生白色沉淀和无色气体,该反应的离子方程式为___________________。
(4)pH=2的某酸HnA(An-为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8,反应生成的正盐的化学式为_________,盐中________离子一定能水解,其第一步水解的离子方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如下:

已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水。
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10-13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。

③六价铬在溶液中物种分布分数与pH关系如右图所示。
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成。
(1)实验时需要配制100 mL 3mol·L-1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要的玻璃仪器是________。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是________。
(3) “氧化”时H2O2滴加速度不宜过快,其原因是____________________________;“氧化”时发生反应的离子方程式为__________________________________________________。
(4) “煮沸”的目的是________。
(5) 请设计用“冷却液”制备PbCrO4的实验方案:________[实验中须使用的试剂有:6 mol·L-1的醋酸, 0.5 mol·L-1Pb(NO3)2溶液, pH试纸]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com