
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 28g乙烯与环丁烷的混合气体中含有6NA个原子
B. 足量MnO2和含有2molHCl的浓盐酸共热,完全反应可生成0.5NA个Cl2分子
C. 标准状况下,22.4LNO2溶于水转移NA个电子
D. 6g金刚石中含有2NA个碳碳单健
查看答案和解析>>
科目: 来源: 题型:
【题目】小明按下图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象。

(1)小明的实验目的是:__________________________。
(2)装置中长玻璃导管的作用是:_________________;红墨水的作用是________。
(3)你估计两根玻璃导管中的实验现象是_____________;理由是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Al3+、Cu2+、I-、S2O32-
B. 常温下,加水冲稀时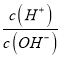 的值明显增大的溶液:CH3COO-、Ba2+、NO3-、Br-
的值明显增大的溶液:CH3COO-、Ba2+、NO3-、Br-
C. 0.1mol·L-1Fe(NO3)2溶液:[Fe(CN)6]3-、Na+、SO42-、Cl-
D. 加入铝粉放出氢气的溶液:K+、Cl-、Mg2+、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇分子中各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是 ( )
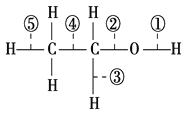
A. 和金属钠反应时键①断裂
B. 和浓H2SO4共热到170 ℃时键②和⑤断裂,和浓H2SO4共热到140 ℃时键①②断裂
C. 乙醇在氧气中完全燃烧,键①②断裂
D. 在Ag催化下与O2反应时键①和③断裂
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家在多年前就探测到火星大气中存在微量的羰基硫(OCS)。已知有关OCS的反应有CO+S![]() OCS,2OCS+SO2
OCS,2OCS+SO2![]() 2CO2+3S。下列说法不正确的是( )
2CO2+3S。下列说法不正确的是( )
A. CO2分子中每个原子最外层都达到了8电子稳定结构 B. 原子半径:S>C>O
C. OCS和CO2都含离子键 D. OCS属于共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O72H2O),其主要反应为:
(1)4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A. 反应(1)和(2)均为氧化还原反应
B. 反应(1)的氧化剂是O2,还原剂是FeOCr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应(1)中每生成1molNa2CrO4时电子转移3mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用滴定管量取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为cmol/L的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是____________________→D→______(均用字母填写)。
(2)读取盛装cmol/L标准硫酸溶液装入酸式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(3)E中在锥形瓶下垫一张白纸的作用是__________________。
(4)D步骤中尖嘴部有气泡,滴定后气泡消失,则所测纯度_______(填“偏高”、“偏低”或“不变”) 。
(5)滴定终点时锥形瓶内溶液的pH约为_________,终点时颜色变化是_____________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?______(填“偏高”、“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为_________________(用V1 、V2 、W和c表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO﹣+4OH﹣═2RO4n﹣+3Cl﹣+5H2O,则RO4n﹣中R的化合价是( )
A.+3
B.+4
C.+5
D.+6
查看答案和解析>>
科目: 来源: 题型:
【题目】CO的燃烧热为akJ/mol,将CO燃烧产物通入一定浓度的NaOH溶液中,所得溶液中溶质仅为Na2CO3,浓度为0.01mol/L。
(1)写出CO完全燃烧的热化学方程式__________________________;
(2)Na2CO3溶液呈碱性,可以用来去油污,用离子方程式表示Na2CO3呈碱性的原因___________________________________;
(3)写出Na2CO3溶液中的电荷守恒关系__________;(用离子浓度符号表示)
(4)计算在该浓度的Na2CO3溶液中c(CO32-)+c(HCO3-)+c(H2CO3)=____mol/L
(5)向该溶液中滴加AlCl3溶液,会有气泡和白色沉淀生成,写出发生反应的离子方程式__________________________。
(6)已知Cu(OH)2的溶度积为Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________;要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:A(g) +2B(g)![]() C(p)。反应过程中测定的部分数据见下表:
C(p)。反应过程中测定的部分数据见下表:
反应时间/min | n(A)/mol | n(B)/ mol |
0 | 1.00 | 1.20 |
10 | 0.50 | |
30 | 0.20 |
下列说法错误的是
A. 前10min内反应的平均速率为v(C)=0.0250 mnol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.50molA气体和0.60mo1B气体,到达平衡时,n(C)<0.25mo1
C. 其他条件不变时,向平衡体系中再充入0.50molA,与原平衡相比,达平衡时B的转化率增大,A的体积分数增大
D. 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com