
科目: 来源: 题型:
【题目】现有三组混合液体:①乙酸乙酯和乙酸钠溶液,②乙醇和己醇,③碘化钠和单质碘的水溶液。分离以上混合液的正确方法依次是
A. 蒸馏、萃取、分液 B. 分液、萃取、蒸馏 C. 分液、蒸馏、萃取 D. 萃取、蒸馏、分液
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是
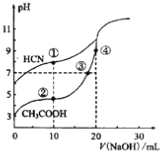
A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. 点④所示溶液液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,将2.0molA(g)和2.0molB(g)充入体积为1L的密闭容器中,在一定条件发生下述反应:A(g)+B(g)![]() 2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
A. t时刻反应达到平衡时,A(g)的体积分数为20%
B. T℃时该反应的化学平衡常数Kc=2
C. t时刻反应达到平衡后,缩小容器体积,平衡逆向移动
D. 相同条件下,若将1.0molA(g)和1.0molB(g)充入同样容器,达到平衡后,A(g)的转化率为50%
查看答案和解析>>
科目: 来源: 题型:
【题目】“探险队员”-盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。

(1)在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有_____个,属于氧化还原反应的有______个,其中能“吃掉”盐酸的盐是_________(填化学式),写出该反应的离子方程式__________________。
(2)在不能与盐酸反应的物质中,属于电解质的是__________(填写物质序号,下同),属于非电解质的是_______________。
(3)请你帮助它走出迷宫(用图中物质前的序号连接起来表示所走的路线)_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】同分异构现象是有机化学中的一种普遍现象。互为同分异构体的物质不可能具有
A. 相同的相对分子质量 B. 相同的结构
C. 相同的通式 D. 相同的分子式
查看答案和解析>>
科目: 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器可将汽车尾气中主要污染物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
②C和CO的燃烧热(△H)分别为-393.5 kJ/mol和-283 kJ/mol
则2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=_______ kJ/mol。
(2)将 0.20 mol NO 和 0.10 mol CO充入一 个容 积 为 1L 的密闭容器中,反应过程中物质浓度变化如图所示。

①0~9 min 内 的平均反应速率v(N2)=____mol/(L ·min) (保留两位有效数字);第12min时改变的反应条件可能为_____ (填字母).
A.升高温度 B.加入NO C.降低温度 D.加催化剂
②该反应在第24min时达到平衡状态,CO的体积分数为____(保留三位有效数字),化学平衡常数K=_______(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表可)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol/LHCOONa溶液的pH=10,则HCOOH 的电离常数Ka=_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的位置关系如图:
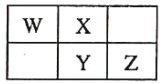
I.若Y元素原子的最外层电子数是电子层数的2倍。
(1)Z在周期表中的位置是___。
(2)写出铜和W的最高价氧化物的水化物的稀溶液反应的离子方程式:__________。
(3)Z最高价氧化物的水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子发生转移时,共产生9mol气体,写出该反应的化学方程式:____________。
II.若X和Y的核外电子数之和为22。
(4)X的气态氢化物的电子式为______,将该氢化物通入硝酸溶液中,恰好反应时所得溶液中离子浓度大小的顺序为____________。
(5)W的单质与Z的最高价氧化物的水化物的浓溶液反应,当电子转移0.4mol时,产生气体的体积是_________(标准状况)。
(6)下列能比较Z元素与氯元素非金属性强弱的是_________。
A.氯气通入硫化钠溶液中,溶液变浑浊
B.盐酸是强酸,氢硫酸是弱酸
C.氯化氢比硫化氢稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com