
科目: 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,按单质、化合物、混合物顺序排列的是( )
A.铁、四氧化三铁、冰水混合物B.氯气、碳酸钠、漂白粉
C.水银、空气、干冰D.二氧化硫、水蒸气、盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】现将200mL0.01mol/LNaOH与50mL某浓度的Ca (OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH﹣的物质的量浓度是0.016mol/L,则Ca(OH)2溶液的物质的量浓度是mol/L.
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ/mol
CH2=CH2(g)+4H2O(g) △H=akJ/mol
请回答:
(1)已知:H2和CH2=CH的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)![]() H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
(2)上述由CO2合成CH2=CH2的反应在________下自发进行(填“高温”或“低温”)。
(3)在体积为1L的恒容密闭容器中,充入3molH2和1molCO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是________。
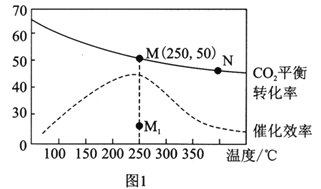
A.平衡常数大小:KMN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n(H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
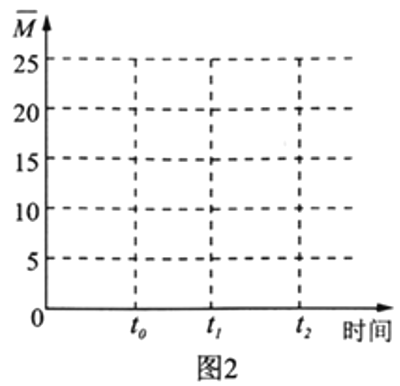
(4)保持温度不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,t0时达到化学平衡。请在图2中作出容器内混合气体的平均相对分子质量![]() 随时间变化的图象。___________
随时间变化的图象。___________
Ⅱ.利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
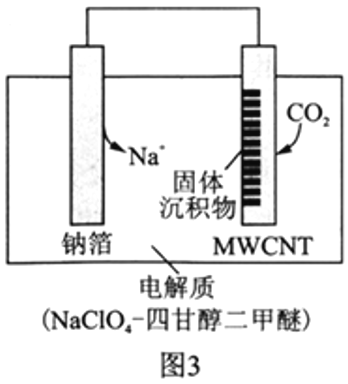
(5)放电时,正极的电极反应式为__________________。
(6)若生成的Na2CO3和C全部沉积在正极表面,当转移0.2mole-时,正极增加的质量为_______g。
(7)选用高氯酸钠四甘醇二甲醚做电解液的优点是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用地壳中硅元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用.例如:
(1)光导纤维的主要成分是________
(2)目前应用最多的太阳能电池的光电转化材料是________
(3)赏心悦目的雕花玻璃是用一种物质对玻璃进行化学刻蚀而制成的,该反应的化学方程式为________
(4)工业上制取粗硅是用石英和焦炭在高温电炉中反应制得,该反应中氧化剂与还原剂的质量比为 ________;用石英和焦炭在高温电炉中反应也可以制得金刚砂(SiC),并产生CO气体,该反应中氧化剂和还原剂的物质的量之比为________
(5)将表面已氧化的铝箔放入氢氧化钠溶液中,反应的离子方程式分别是________、________
(6)用铝箔包裹0.1mol金属钠,用针扎若干小孔后,放入水中,完全反应后,用排水法收集到标准状况下气体的体积________(填字母序号).
a.等于1.12L b.大于1.12L c.小于1.12L.
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖被授予来自美国和日本的三位科学家,以表彰他们在“Y离子”电池研发领域作出的贡献。Y元素在海水和盐湖中含量较为丰富,Y元素是( )
A.钠B.碘C.溴D.锂
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
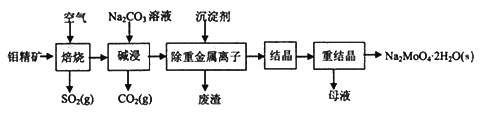
回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将HC1气体通入到1L浓度均为0.1mol/L的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是

A. Ka(HB)的数量级为10-9
B. 酸性的强弱顺序为HCl>HA>HB
C. 当通入0.1molHC1气体时,c(B-)>c(A-)
D. 当混合溶液呈中性时,c(Na+)=c(Cl-)+c(A-)+c(B-)
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题.
(1)久置的硅酸钠溶液会出现浑浊现象其原因为________(用化学方程式表示)
(2)红热的木炭与浓硫酸反应的化学方程式________
(3)SO2催化氧化成SO3的化学方程式:________
(4)写出铜与稀硝酸反应的离子方程式________
(5)实验室制取氨气的化学方程式为 ________,常用________来干燥氨气.
(6)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是_______.
②氧化剂与氧化产物的物质的量比是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com