
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 1mol苯乙烯中含碳碳双键数为4NA
B. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C. 标准状况下,2.24LCl2溶于水,转移6.02×1022个电子
D. 1L0.1molL-1的氨水中有0.1NA个NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
(1)实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A,B,C所示。
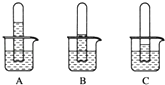
(i)在相同条件下,三种气体在水中溶解度最大的是_____,写出A烧杯中发生反应的化学方程式:________。
(2)实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图D,E,F所示.一段时间后,D,E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
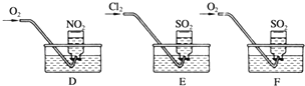
(ii)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:________。
②假设该实验条件下,气体摩尔体积为aLmol﹣1,则装置D的集气瓶中所得溶液溶质的物质的量浓度为_____。
(iii)实验前在F装置的水槽里滴加几滴紫色石蕊试液,观察到的现象是________,通入氧气后,可能观察到的实验现象是________,写出反应的化学方程式:________。
(iv)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,写出有关反应的离子方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷在氧气中燃烧,可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出XKJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是________。
(2)已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O3的热化学反应方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-==2A1O2-+ H2O
B. 小苏打用于治疗胃酸过多:CO32-+2H+==CO2↑+H2O
C. 黄色的AgI悬浊液中加入Na2S溶液后变黑:2Ag++S2-=Ag2S ↓
D. 用惰性电极电解熔融氯化钠:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。

(1)仪器连接的顺序(用接口序号字母表示)是:a________。
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:________。
(3)将装置C中两种液体分离开的操作名称是________。
(4)(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题。
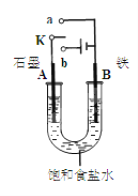
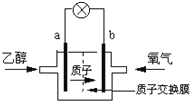
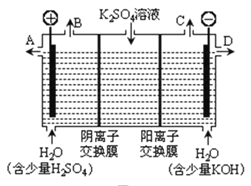
图1图2图3
(1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________
②若开始时开关K与b连接,则总反应的离子方程式为 ___________________________
(2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示:
①______极(填a或b)为电池的正极,电池工作时电流方向为_________(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阴极反应式为_____________________。
②制得的硫酸溶液从出口____(填“A”、“D”)导出,并简述原因__________________________(请用化学用语和文字解释)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )

A. 浓H2SO4 B. NaOH溶液 C. Na2SO3溶液 D. 饱和NaCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如右下图(二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃)。实验步骤为:
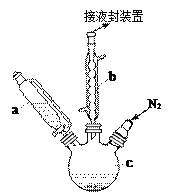

①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(密度0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25ml装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入仪器d,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是_________,作用是_________________________。
(2)步骤①中通入氮气的目的是________________________________。
(3)仪器c的适宜容积应为______:①100ml、②250ml、③500ml;仪器a使用前应进行的操作是_____,其操作过程为:关闭恒压滴液漏斗颈部旋塞_______________________。
(4)KOH、FeCl2、C5H6反应生成二茂铁[Fe(C5H5)2]和KCl的化学方程式为________________________________;步骤⑦是二茂铁粗产品的提纯,该过程在右图中进行,其操作名称为__________。
(5)为了确证得到的是二茂铁,还需要进行的一项简单实验是_____。
(6)最终得到纯净的二茂铁3.7g,则该实验的产率为_______(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)的分解反应。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15 | 20 | 25 | 30 | 35 |
平衡总压强/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①该可逆反应的平衡常数的表达式为________________________
②可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中CO2的体积分数不变
D.密闭容器中总压强不变
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25 ℃下达到分解平衡。若在恒温下增大容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。该反应的焓变ΔH______0(填“>”、“=”或“<”,下同),熵变ΔS_______0
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g) ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式_________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com