
科目: 来源: 题型:
【题目】由 Al、CuO、Fe2O3 组成的混合物共 10.0g,放入 500mL 某浓度盐酸溶液中,混合物完全溶解,当再 加入 250mL 2.0mol/L 的 NaOH 溶液时,得到的沉淀最多。该盐酸的浓度为( )
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式表达正确的是( )
A. 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-=BaSO4↓+Al(OH)3↓
B. 将铁粉加入到稀硫酸种:2Fe+6H+=2Fe3++3H2↑
C. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O
D. NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】混合动力汽车(HEV) 中使用了镍氢电池,其工作原理如图所示:其中M 为储氢合金,MH 为吸附了氢原子的储氢合金,KOH 溶液作电解液。关于镍氢电池,下列说法不正确的是

A. 充电时,阴极附近pH 降低
B. 电动机工作时溶液中OH-向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e- =Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH![]() M+Ni(OH)2
M+Ni(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如下:
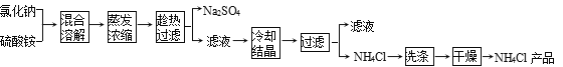
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如下图所示:
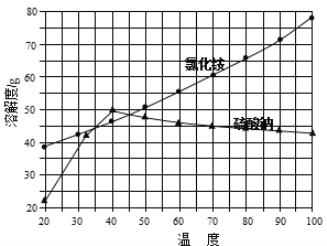
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: 。
(2)欲制备10.7 g NH4Cl,理论上需NaCl质量为 g。
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 。
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |
查看答案和解析>>
科目: 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100 nm之间的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀地分散入蒸馏水中,得到的物质()
①是溶液 ②是胶体 ③具有丁达尔效应 ④能透过滤纸 ⑤静置会立即形成沉淀
A.②③④B.②③⑤C.①④⑤D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下用0.2mol·L-1 HA溶液与0.2mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则
(1)该溶液显_____性(填“酸”、“碱”或“中”),原因是______________(用离子方程式表示)
(2)混合溶液中c(HA)+c(A-)____0.1mol·L-1(填“>”、“<”或“=”,下 同)
(3)如果取0.2mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度____NaA的水解程度。
(4)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA- HA-![]() H++A2-
H++A2-
回答下列问题:
①Na2A溶液显____________(填“酸性”,“中性”,或“碱性”)。理由是____________________________________________(用离子方程式表示)
②在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A.32g氧气所含的原子数目为NA
B.18g水所含的电子数目为NA
C.在常温常压下11.2L氯气所含的原子数目为NA
D.2.3g金属钠变为钠离子时失去的电子数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g)![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/mol·L-1 | c(I2)/mol·L-1 | c(HI)/mol·L-1 | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | —— |
下列判断正确的是
A. H2的平衡浓度:a=b>0.004 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率等于20% D. 丙中条件下,该反应的平衡常数K=4
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室配制1000mL0.50mol·L-1的Na2CO3溶液,在常用仪器中应选用______mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度______0.50mol·L-1(填“大于”、“小于”或“等于”)。
(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在______式滴定管中。若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
则c(HCl)=______mol·L-1。
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______,若原来配制所称取的Na2CO3固体中混有Na2CO3·10H2O,则实验误差为______(以上两空填“偏高”、“偏低”或“无影响”)
(4)常温下向20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:

①请写出AB段反应的离子方程式___________________________________
当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)_____________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】对于下列实验事实的解释,不合理的是
选项 | 实验事实 | 解释 |
A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
C | 浓HNO3能氧化NO,稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH2O |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com