
科目: 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理及电池中发生的主要反应如图所示。下列说法正确的是( )

A. 镀铂导电玻璃的作用是传递I-
B. 电池工作时,光能转变为电能,X 为电池的正极
C. 电解质溶液中发生反应:2Ru3++3I-=2Ru2++I3-
D. 电池的电解质溶液中I-和I3-的浓度均不断减小
查看答案和解析>>
科目: 来源: 题型:
【题目】现有浓度各为1 mol/L的FeCl3 、FeCl2 、CuCl2 的混合溶液100 mL,加入一定量的铁粉,按下列情况填空:
(1)反应完毕后,铁粉有剩余。
①反应完毕后,溶液中一定含有__________阳离子,为__________mol,一定没有__________阳离子。
②固体物质烘干后,其中一定有__________和__________,和反应前加入的铁粉质量相比__________(填“多”或“少”)__________g。
(2)反应完毕后,有铜生成,铁粉无剩余。
①反应后的溶液中一定含有__________阳离子,该阳离子在溶液中的物质的量的范围是__________。
②溶液中可能含有__________阳离子,该阳离子在溶液中物质的量的可能存在范围是__________。
③溶液中一定不含__________阳离子。
④溶液的质量__________(填“增加”或“减少”)。
(3)反应完毕后,无固体沉淀物存在,反应后的溶液中一定含__________和__________阳离子,它们中物质的量为定值的是__________阳离子,为__________mol;它们中的物质的量为一数值范围的是__________阳离子,该数值范围是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】取Fe和Fe2O3 的混合物 15 g,加入150 mL 2 mol/L 的稀硫酸,固体混合物完全溶解,放出气体 1.68 L(标准状况下),向所得溶液中滴入硫氰化钾溶液,未见颜色变化。若要使该溶液中的铁元素完全转化为沉淀,需加入3 mol/L 的NaOH溶液的体积为( )
A. 150 mL B. 200 mL C. 225 mL D. 250 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的工业原料,某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。他们利用该反应设计如图所示制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O。他们利用该反应设计如图所示制取氯气并验证其性质的实验。
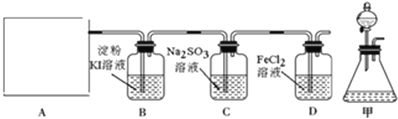
回答下列问题:
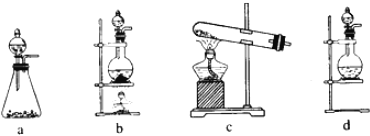
(1)该实验中A部分的装置是______(填标号)。
(2)装置B中产生的现象为______。
(3)请设计实验验证装置C中的Na2SO3已被氧化______。
(4)写出D装置中发生反应的离子方程式______。
(5)该实验存在明显的缺陷,请你提出改进的方法______。
(6)若将上述装置改为制取SO2并分别验证SO2的漂白性、氧化性和还原性等性质。B中______溶液褪色,则说明产生的气体为SO2;C中Na2S溶液出现______;D中______溶液褪色,说明SO2有还原性。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,体积均为20mL、浓度均为0.1mol·L-1的两种酸HX、HY分别与0.1mol·L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )

A. Ka(HY)的数量级约为10-3
B. a点c(X-)>b点c(Y-)
C. HX发生反应的离子方程式为HX+OH-=X-+H2O
D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在某一容积为2 L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:

回答下列问题:
①该反应的化学方程式为__________________________________。
②前2 min用A的浓度变化表示的化学反应速率为________。在2 min时,图像发生改变的原因是________(填字母)。
A.增大压强 B.降低温度 C.加入催化剂 D.增加A的物质的量
(2)在100 ℃时,将0.01 mol的四氧化二氮气体充入0.1 L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式________________________________,达到平衡时四氧化二氮的转化率为_______。
②在0~20 s内,四氧化二氮的平均反应速率为______,哪一时间段______(指0~20、20~40、40~60、60~80、80~100 s)反应速率最大并解释______。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:

(1)该反应为______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是______(填字母)。
A.改铁片为铁粉 B.增大压强 C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____极(填“正”或“负”)。铜片上产生的现象为______,该极上发生的电极反应为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) ![]() H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是
H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是

A. 电路中每流过2mol电子,电池内部释放316kJ热能
B. 每34gH2S参与反应,有2mol H+经质子膜进入正极区
C. 电极a为电池的负极
D. 电极b上发生的电极反应为:O2+4e![]() +4 H+=2H2O
+4 H+=2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是

A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com