
科目: 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:____Mo+____HF+____HNO3=____ MoO2F2+____ MoOF4+____NO2↑+____ _________
(2)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =_________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(3)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
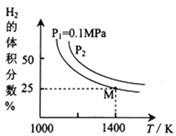
①由图可知,该反应的ΔH__0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
查看答案和解析>>
科目: 来源: 题型:
【题目】10月11日早上7点30分,万众瞩目的神舟十一号飞船发射成功.其运载火箭点火后,偏二甲肼与四氧化二氮发生剧烈的氧化还原反应:(CH3)2NNH2+2N2O4═2CO2+4H2O+3N2 , 该反应中四氧化二氮属于( )
A.还原剂
B.氧化剂
C.还原产物
D.氧化产物
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成份为FeTiO3)制取钛并获得副产品绿矾的工艺流程如下:
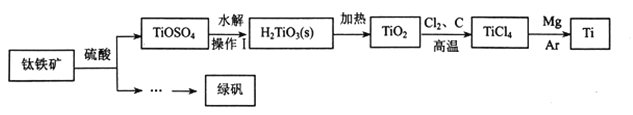
(1)TiOSO4中钛的化合价为_________,操作I的名称是为_________。
(2)TiOSO4经水解得H2TiO3的化学方程式为_________。
(3)TIO2与焦炭和Cl2在高温下反应得TiCl4井产生还原性气体,相应的化学方程式为_________。
(4)加热Mg与TiCl4得到钛时,Ar的作用是_________。
(5)某厂用3.8吨纯度为40%的钛铁矿制取钛,理论上至少需要氯气______L(标准状况下)。
(6)已知K3[Fe(CN)6](铁氰化钾》和K4[Fe(CN)6](亚铁氰化钾)能发生如下反应:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀),4Fe3++3(Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
①确定绿矾部分被氧化的方法是___________________________。(可供选择的试剂:铁氰化钾溶液、亚铁氧化钾溶液。铁粉、KSCN溶液)
②室温下,将绿矾配成0.1mol·L-1FeSO4溶液,测得溶液的pH=3,请用离子方程式解释原因_____________________,该溶液中c(SO42-)-c(Fe2+)≈_________________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液的氧化性,催熟水果
D.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M可从酸牛奶中提取。已知纯净的M为无色黏稠液体, 易溶于水。为研究M的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取M4.5 g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空:(1)M的摩尔质量为: __ 。 |
(2)将此4.5 g M 在足量纯 O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6 g | (2)M的分子式为:____ 。 |
(3)通过M 的红外光谱图发现该分子中既有 羟基,还有羧基 | (3)写出M中含有的官能团羟基电子式:__ |
(4)M 的核磁共振氢谱如下图:
| (4)M 中含有___种氢原子。 |
(5)综上所述,M 的结构简式为_____ 。 | |
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
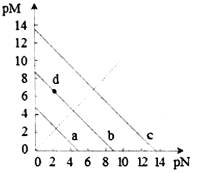
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=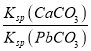
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组设计如下装置处理pH为5-6的污水。下列说法正确的是
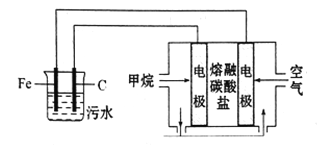
A. 阳极的电极反应式为:Fe-3e-=Fe3+
B. 正极的电极反应式为:O2+2H2O+4e-=4OH-
C. 若阴极转移2mol电子,则负极消耗5.6LCH4
D. 污水中最终会产生Fe(OH)3,吸附污物而形成沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用密度为1.18 g·mL-1,质量分数为36.5%浓盐酸配制250 mL 0.1 mol·L-1 的盐酸,填空并回答下列问题:
(1)配制250 mL 0.1 mol·L-1的盐酸___________。
应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 容量瓶外还需的其他仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________。
A.用30 mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是___________,溶液注入容量瓶前需恢复到室温,这是因为___________;
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线___________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空
(1)官能团-COOH的名称是___________________;
(2)(CH3CH2)2C(CH3)2的名称为__________________;
(3)2-甲基-1-丁烯的键线式________________________;
(4)相对分子质量最小的有机物分子式____;
(5)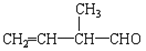 所含官能团的名称是_____________;该有机物发生加聚反应后,所得产物的结构简式为_________________;
所含官能团的名称是_____________;该有机物发生加聚反应后,所得产物的结构简式为_________________;
(6)3-甲基戊烷的一氯代产物有_________种(不考虑立体异构)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是

A. X→Y反应类型为酯化反应
B. X、Y、Z均能使溴的四氯化碳溶液褪色
C. Y和Z互为同分异构体
D. 等物质的量的X、Z分别与足量Na反应,消耗Na的物质的量之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com