
科目: 来源: 题型:
【题目】下图是石蜡油在炽热碎瓷片的作用下产生乙烯,并检验乙烯性质的实验。
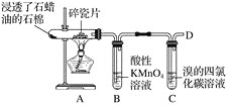
回答下列问题:
(1)从装置A中出来的气体中含有烷烃和________。
(2)B中酸性高锰酸钾溶液________,这是因为生成的气体被________(填“氧化”或“还原”),反应类型为________。
(3)C中溴的四氯化碳溶液________,发生反应的化学方程式:____________,反应类型为________。
(4)在D处点燃之前必须进行的操作是__________,燃烧时反应的化学方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将10g CaCO3粉末放入500mL的盐酸中,恰好完全反应。计算:
(1)理论上在标准状况下生成的CO2气体体积_________。
(2)盐酸的物质的量浓度___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制备二氧化硫

若使用上图所示装置制备干燥的SO2气体,回答以下问题:
①A中盛液体的玻璃仪器名称是____________,实验开始后A中反应的化学方程式为______________________________________________________。
②B装置的作用是_______________________;C装置的作用____________________。
③E中固体试剂为________________。
(2)制备保险粉
如下图,维持35~45℃通SO2至锌粉-水悬浮液反应生成ZnS2O4;然后加入18%的氢氧化钠溶液,在28~35℃下反应生成Na2S2O4和Zn(OH)2悬浮液。

反应物经压滤除去氢氧化锌沉淀后,往滤液中加入氯化钠,并冷却至20℃,使Na2S2O4结晶析出,滤出晶体后用酒精脱水干燥即得产品。
①在制取Na2S2O4过程中发生了氧化还原反应,氧化剂是___________;生成1mol Na2S2O4转移电子______mol。
②滤液中加入氯化钠使_______离子浓度增大,促进Na2S2O4结晶析出;滤出晶体后用酒精脱水干燥是因为Na2S2O4在酒精中的溶解度_______(填“较大”或“较小”),且酒精易挥发。
③制取Na2S2O4也常用甲酸钠法,控制温度70~80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液微酸性,即可生成Na2S2O4,反应的离子方程式:_________________________________________。
(3)测定保险粉纯度
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4 + 6KMnO4 + 4H2SO4 = 5Na2SO4 + 3K2SO4 + 6MnSO4 + 4H2O
称取3.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·L-1的KMnO4溶液滴定。
重复上述操作2次,平均消耗KMnO4溶液18.00 mL则该样品中Na2S2O4的质量分数为_____________(杂质不参与反应)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年10月17日,我国神舟11号飞船发射在即,长征三号丙型运载火箭开始加注燃料.长征三号丙型火箭第一级和第二级采用偏二甲肼(UDMH)和N2O4为动力源,反应方程式为:(CH3)2N2H2+2N2O4=2CO2+4H2O+3N2 , 关于该反应的说法中正确的是( )
A.该反应不是氧化还原反应
B.氮气只是氧化产物
C.N2O4是还原剂
D.N2O4是氧化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用沉淀剂最好为( )
A. 硫化物 B. 硫酸盐
C. 碳酸盐 D. 以上沉淀剂均可
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
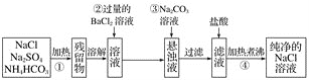
如果此方案正确,那么:
(1)操作①可选择_______仪器。
(2)操作②是否可改为加硝酸钡溶液__________,原因是___________。
(3)进行操作②后,判断硫酸根离子已除尽的方法是_____________。
(4)操作③的目的是_______,不先过滤后加碳酸钠溶液的理由是__________。
(5)操作④的目的是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(多选)下列各组中的离子,能在溶液中大量共存的是( )
A.Cu2+、H+、Cl﹣、SO42﹣
B.Na+、Fe3+、SO42﹣、OH﹣
C.H+、Na+、CO32﹣、NO32﹣
D.K+、Na+、Cl﹣、OH﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】硼、铝属元素周期表IIIA短周期元素。回答下列问题:
(1)基态B原子的价电子轨道表达式为__________,其第一电离能比Be ________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,能体现配位键的结构式为__________,与氨硼烷互为等电子体的烃的分子式为__________。
(3)插图 | (4)插图 | (5)插图 |
(3)常温常压下硼酸晶体为结构层状,其二维平面结构如图所示:
硼酸的化学式为__________,B原子的杂化类型为_______。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:_____________________________________。
(4)8-羟基喹啉铝是一种黄色粉末,它是OLED中的重要发光材料及电子传输材料,其微观结构如图所示,8-羟基喹啉铝中存在的化学键为______________。
A.金属键 B.极性键 C.非极性键 D.配位键 E.π键
(5)金属铝晶体中原子呈面心立方紧密堆积(如上图)。该晶胞空间利用率为_________________(用含π的代数式表示);铝的密度是2.7gcm-3,阿伏伽德罗常数为NA,依此可计算出Al原子半径r(Al)=__________cm.
查看答案和解析>>
科目: 来源: 题型:
【题目】某菱铁矿的主要成分是FeCO3,还含有SiO2、少量CaCO3和 Al2O3。下图是利用该菱铁矿制备磁性Fe3O4胶体粒子的简要工艺流程:

(1)菱铁矿石粉碎的目的是______________________________;碱浸可否用较便宜的Ca(OH)2替代NaOH?说明理由:______________________________________________。
(2) “不溶物”加稀盐酸可否改用不易挥发的稀硫酸?说明理由___________________________________________;“不溶物”加稀盐酸后“部分氧化”之前还有项操作,化学实验名称为__________。
(3) “部分氧化”离子方程式为________________________________________。
(4)如何实验验证“部分氧化”的滤液中存在Fe2+?__________________________________________________________________________________。
(5)Fe3O4胶粒的直径的范围是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识回答下列问题:

(1)上图所示的物质分类方法名称是___________________________________。
(2)以K、Na、H、O、S、N中任两种或三种元素组合成合适的物质,分别填在下表中②、④后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_____ | ③NaOH ④______ | ⑤Na2SO4 | ⑥NO2 | ⑦NH3 |
(3)写出⑥与水反应的化学方程式:_______________________________。
(4)实验室制备⑦常用_______和_______加热反应,检验该气体的方法是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com