
科目: 来源: 题型:
【题目】CuSO4溶液与Na2CO3溶液混合时产生蓝绿色沉淀,某实验小组进行实验,探究蓝绿色沉淀的组成。
【查阅资料】
i.氢氧化铜是一种蓝色絮状沉淀,难溶于水,溶于酸、氨水等,受热会分解。
ii.碳酸铜是蓝绿色粉末状固体,受热易分解,遇水转化为氢氧化铜和碱式碳酸铜的混合物。
iii.碱式碳酸铜呈孔雀绿颜色,又叫孔雀石,难溶于水,溶于酸、氨水等,在空气中加热会分解。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为CuCO3
假设3:沉淀为碱式碳酸铜[化学式可表示为xCuCO3yCu(OH)2]
(1)假设1中产生沉淀Cu(OH)2的离子方程式是_______。
(2)甲同学认为假设2不成立,理由是_______。
【定性实验】
(3)实验小组同学将沉淀从溶液中分离并净化,取少量净化后的固体于试管中,滴加稀硫酸,观察到_______,证明假设3成立。
【定量实验】
为了确定碱式碳酸铜化学式中x与y的关系,实验小组称取净化后的蓝绿色固体m1 g,使用下列装置(夹持仪器未画出)进行实验。

(4)B、C、D中的试剂依次为_______(填标号)。
a.澄清石灰水 b.碱石灰 c.氯化钙溶液 d.浓硫酸
(5)各装置接口的连接顺序:a→_______(填字母序号)。
(6)装置D的作用是_______。
(7)加热到固体完全分解,硬质玻璃管中得到黑色固体,其余产物被相应装置完全吸收。实验结束后,测得装置B的质量增加m2 g,则xCuCO3yCu(OH)2中![]() =_______(列式表示)。若无D装置,则
=_______(列式表示)。若无D装置,则![]() 的值_______(填“偏大”或“偏小”或“无影响”)。
的值_______(填“偏大”或“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,a、b、c、d均为石墨电极,通电进行电解,下列说法正确的是( )
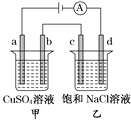
A. 电路中电子流向:负极→d→c→b→a→正极
B. a、c两极产生气体的物质的量相等
C. SO42-向b电极运动,Cl-向c电极运动
D. 通电后乙烧杯滴入酚酞溶液d极会变红
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。
查看答案和解析>>
科目: 来源: 题型:
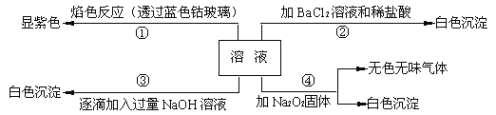
【题目】有一无色溶液,其中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:
等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:
第③个实验中,生成白色沉淀的量与加入![]() 的量有如下图所示的相互关系。据此可知:
的量有如下图所示的相互关系。据此可知:
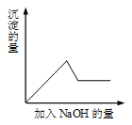
(1)在原溶液中一定存在的离子有______;一定不存在的离子有______;不能确定是否存在的离子有______。
(2)写出第③个实验中发生反应的离子方程式____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.摩尔是七个基本物理量之一
B.1mol任何物质都含有6.02×1023个分子
C.1mol氧的质量为32g
D.摩尔质量在数值上等于该物质的相对分子质量或相对原子质量
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。下列说法正确的是

A. M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L
B. N点溶液呈酸性,则c(Na+) < 3c(HA-)
C. 若N点溶液pH =4.2,则Ka2(H2A)的数量级为104
D. V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
A. 10 s内,NH3的平均反应速率为0.008 mol·L-1·s-1
B. 该反应达到平衡时6v正(O2)=5v逆(H2O)
C. 10 s内,反应放出的热量为0.1a kJ
D. 10 s时,H2O的反应速率为0.012 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x
x
A. ![]() (O2) = 0.01mol·(L·s) –1 B.
(O2) = 0.01mol·(L·s) –1 B. ![]() (NO) = 0.008mol·(L·s) –1
(NO) = 0.008mol·(L·s) –1
C. ![]() (H2O) = 0.006mol·(L·s) –1 D.
(H2O) = 0.006mol·(L·s) –1 D. ![]() (NH3) = 0.002mol·(L·s) –1
(NH3) = 0.002mol·(L·s) –1
查看答案和解析>>
科目: 来源: 题型:
【题目】把4molA和2.5molB混合于2L密闭容器中,发生反应:3A(g)+2B(s)![]() xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
A. A的平均反应速率为0.15mol·L-1·min-1 B. 平衡时,C的浓度为0.25 mol·L-1
C. B的平均反应速率为0.1mol·L-1·min-1 D. 平衡时,容器内压强为原来的0.875倍
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图回答,下列说法不正确的是( )

A. 燃料电池中正极反应为![]() O2+2e﹣+2H+═H2O
O2+2e﹣+2H+═H2O
B. 此装置用于电镀铜时,硫酸铜溶液的浓度不变
C. 此装置用于铁表面镀铜时,a为铁
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com