
科目: 来源: 题型:
【题目】用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。

(1)基态Fe原子价层电子排布式是_______。
(2)已知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁甲酰胺晶体为_______晶体。
(3)二茂铁甲酰胺中碳原子的杂化方式为_________,H、C、N、O四种元素的电负性由大到小的顺序是_________。
(4)碳、氮元素对应的最简单氢化物分别是CH4和NH3,相同条件下CH4的沸点比NH3的沸点_______(填“高”或“低”),主要原因是_______。
(5)氢、氮、氧三种元素按照4:2:3的原子个数比形成离子化合物。该离子化合物中,阳离子空间构型是_______,1 mol阴离子含有σ键的数目为_______。
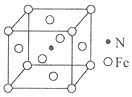
(6)氮和铁能形成一种磁性材料,其晶胞如图所示,该磁性材料的化学式为_______。已知晶胞参数为a nm,则该晶胞密度的计算式为ρ=_______g/cm3(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D四种化合物,其焰色反应的火焰均为黄色。其中C是一种淡黄色固体,加热固体A可生成D,同时得到能使澄清石灰水变浑浊的无色气体。A与B溶液混合后可得到D。
(1)写出下列物质的化学式:A、_______;B、_______;C、_______;D、_______。
(2)写出A与B反应的离子方程式:_________________________________________。
(3)在甲、乙、丙、丁四个烧杯中各加入100 mL水,再分别加入0.1 mol 的下列物质:①钠、②氧化钠、③过氧化钠、④氢氧化钠,固体完全溶解后,四个烧杯中溶质的质量分数由大到小的顺序是(填编号)___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】0.1molH2SO4的质量为_________g,配制成500mL溶液后,H2SO4的物质的量浓度为__________mol/L,其中SO42-的物质的量浓度为________mol/L,H+的物质的量浓度为_________mol/L,跟足量的锌完全反应生成的氢气在标准状况下所占的体积为_________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】50mL 1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)大小烧杯间填满碎泡沫塑料的作用___________。
(2)___________(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒。其原因是_________________。
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是_________(填“偏高”或“偏低”或“无影响”)。
(4)如果改用60mL 1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量__________(“增加”、“减少”或“不变”),理由是______________;所求中和热数值_______(“增加”、“减少”或“不变”),理由是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。

请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是_______________________。
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。

查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与进步作出了巨大贡献。
(1)450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
时间 物质的量 | 5 min | 10 min | 15 min | 20 min | 25 min |
n(N2)/mol | 0.36 | 0.35 | 0.275 | 0.25 | 0.25 |
n(H2)/mol | 0.48 | 0.45 | 0.225 | 0.15 | 0.15 |
n(NH3)/mol | 0.08 | 0.1 | 0.25 | 0.30 | 0.30 |
①5~10 min内,生成NH3的平均反应速率是_______ mol/(L·min)。
②下列能作为判断该反应达到化学平衡状态的依据是_______(填字母序号)。
A.v(N2)正=3v(H2)逆 B.容器内压强保持不变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是_______。
(2)合成氨的反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH。
2NH3(g) ΔH。
相关化学键键能数据如下:
化学键 | H—H | N≡N | N—H |
E /(kJ/mol) | 436 | 946 | 391 |
由此计算ΔH=_______kJ/mol,低温下,合成氨反应_______(填“能”或“不能”)自发进行。已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)![]() N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
N2(g)+3H2(g)的活化能Ea2=_______kJ/mol。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应Ⅰ:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H =﹣906kJ/mol
4NO(g)+6H2O(g) △H =﹣906kJ/mol
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol
①该条件下,N2(g)+O2(g)![]() 2NO(g) △H = _______kJ/mol
2NO(g) △H = _______kJ/mol
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应_______(填“反应Ⅰ”或“反应II”)。520℃时,反应Ⅰ的平衡常数K=_______(只列算式不计算)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表。

溶液 | 加入的物质 | 字母代号 |
①饱和石灰水 | 通过量CO2 | ________ |
②AlCl3溶液 | 通过量NH3 | ________ |
③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | ________ |
④AlCl3溶液 | 逐滴加NaOH溶液至过量 | ________ |
⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | ________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) △H2=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) △H2=-192.9 kJ/mol。
(1)甲醇蒸气完全燃烧的热化学反应方程式为__________________________。
(2)反应②中的能量变化如图所示,则△H2=_______kJ/mol(用E1、E2表示)。

(3)H2(g)的燃烧热为_______。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:______(写出两点即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:Ksp[Fe(OH)3]=4.0×1038,Ksp[Cu(OH)2]=2.2×1020

(1)“滤渣1”的主要成分是_______(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②_______(填一种)。
(2)“氧化”过程中,发生氧化还原反应的离子方程式是_______。
(3)“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是_______。
(4)加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×1014mol/L,此时溶液中c(Cu2+)的取值范围是_______mol/L。
(5)加入适量锌粉的作用是_______。
(6)由滤液得到ZnSO47H2O的操作依次为_______、_______、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、_______、_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列各题:
(1)实验室保存FeCl2溶液时,常向其中加入少量铁粉原因是__________________(用离子方程式表示)。
某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:稍取未知试液于试管中![]() 溶液
溶液![]() 溶液呈血红色(证明含有FeCl2),你认为此方案________(填“合理”或“不合理”),若不合理,如何改进_______________________________________(若合理,该问不填)。
溶液呈血红色(证明含有FeCl2),你认为此方案________(填“合理”或“不合理”),若不合理,如何改进_______________________________________(若合理,该问不填)。
(2)A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示:

根据如图所示变化,按要求回答下列问题:
①写出A、E的化学式:A________,E________;
②写出其中几步反应的化学方程式:
C→B:________________________________________________________________________;
B→D:________________________________________________________________________;
E→A:________________________________________________________________________。
③C中加入NaOH溶液,看到的现象是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com