
科目: 来源: 题型:
【题目】消毒剂在生产、生活中有重要的作用,常见的含氯消毒剂有NaClO2、NaClO、ClO2 和Cl2
回答下列问题:
(1)NaClO2所含的化学键类型有________________。
(2)消毒剂投入水中,一段时间后与氨结合得到一种结合性氯胺(NH2Cl)。NH2Cl 在中性或酸性条件下也是一种强杀菌消毒剂,常用于城市自来水消毒。其理由是________________(用化学方程式表示)。
(3) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克Cl2 的氧化能力。上述四种含氯消毒剂中消毒能力最强的是________________。
(4)自来水厂用ClO2 处理后的水中,要求ClO2 的浓度在0.1~0.8 mg·L-1之间。用碘量法检测ClO2 处理后的自来水中ClO2 浓度的实验步骤如下:
步骤Ⅰ.取一定体积的水样,加入足量碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。
步骤Ⅱ.用Na2S2O3 溶液滴定步骤Ⅰ中所得的溶液。
已知:a. 操作时,不同pH 环境中粒子种类如下表所示。
pH | 2 | 7 |
粒子种类 | Cl- | ClO2- |
b. 2S2O32-+I2==S4O62-+2I-。
①步骤Ⅱ中反应结束时溶液呈___________(填“蓝色”或“无色”)
②若水样的体积为1.0L,在步骤Ⅱ中消耗10mL1.0×10-3mol·L-1Na2S2O3 溶液,则该水样中c(ClO2)=___________mg·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4 (g) ![]() N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ![]() 2NH3(g) △H2
2NH3(g) △H2
③7N2H4(g) ![]() 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________(用含△H1和△H2的代数式表示)。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H________(填“>”或“<”)0,N2H4发生分解反应的化学方程式为___________。
(3)T℃时,向一体积为5L 的恒容密闭容器中充入总物质的量为2 mol的CO2和NH3,在一定条件下发生反应:2NH3(g)+CO2(g)====CO(NH2)2(s)+H2O(g)。混合气体中氨气的体积分数随反应时间的变化如图所示。

① 0~60s内,反应速率v(CO2)=________mol/(L·s)
② T℃时,该反应的化学平衡常数K=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锶(Sr)与镁是同主族元素.锶的单质及其化合物用途广泛,例如金属锶用于制造合金、光电管、照明灯,Sr(OH)2用于磨拉石的提纯,Sr(NO3)2用于烟火装置,SrCl2用于修补牙齿等。
(1)锶(Sr)位于周期表的第___周期___族,过氧化锶(SrO2)中锶元素的化合价为______。
(2)金属锶在常温下和水反应,有气体生成,写出该反应的化学方程式______。
(3)金属锶很活泼,在空气中易被氧化,可保存在______中(填序号)。
①水 ②酒精 ③煤油
(4)锶的性质与钙类似。已知:CaCl2 易溶于水,CaF2难溶于水,请写出硝酸锶和氟化钠反应的离子方程式______。
(5)隔绝空气高温焙烧SrSO4和C粉的混合物,若2molSrSO4完全反应,只有S被还原并转移16mol电子,同时只生成一种可燃性气体,该反应的化学方程式:______。
(6)在t℃时,某Sr(OH)2的稀溶液中c(H+)=10—amolL—1,c(OH—)=10—bmolL—1,已知a+b=12.向该溶液中逐滴加入 pH=X 的盐酸,测得混合溶液的部分pH如表所示。
Sr(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的 pH | |
① | |||
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
若忽略溶液混合前后的体积变化,则X为______(用数字填空)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用化学知识填空:
(1)NaHCO3溶液显碱性,用离子方程式表示其原因_______________,其溶液中离子浓度大小顺序为____________________。
(2)向50mL0.018molL﹣1的AgNO3溶液中加入50mL0.020molL﹣1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10﹣10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=____________。
②完全沉淀后,溶液的pH=____________________。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应式为2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2,该电池正极的电极反应式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A.3.01×1023个SO2分子的质量为32g
B.CH4的摩尔质量为16g
C.1 mol H2O的质量为18g/mol
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)Br位于元素周期表第_____周期第_____族;基态Na+核外有_____种运动状态不同的电子;Mg基态原子核外电子排布式为_____。
(2)用“>”或“<”填空:
第一电离能 | 粒子半径 | 熔点 | 键的极性 |
N_____S | S2—_____ Mg2+ | SO3______Na2O2 | H﹣O_____H﹣N |
(3)已知多硫化钠﹣溴储能电池是一种二次电池,结构如图。电池总反应为:2Na2S3+2NaBr![]() 3Na2S2+Br2。
3Na2S2+Br2。
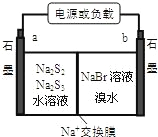
①放电时Na+向_____极迁移(填“a 或 b”);
②充电时阴极电极反应式为:______________。
(4)已知N4为正四面体结构,N﹣N键能为167kJ/mol,N≡N 键能为 942kJ/mol。写 出N4(g)转化为N2(g)的热化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅及其化合物用途非常广泛,已知铅(Pb)与硅同主族且Pb比Si多3个电子层。回答下列问题:
(1)铅位于元素周期表的第__________周期__________族。
(2)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb [(CH3COO)2Pb易溶于水],发生的反应为 PbSO4+2CH3COONH4=(CH3COO)2Pb +(NH4)2SO4,说明(CH3COO)2Pb是_______(填“强”或“弱”)电解质。
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,其中工作“B”为________(填“放电”或“充电”);电解质不能用浓盐酸,否则电池失效并放出大量的氯气,其原因是________(用化学方程式表示)。
2PbSO4+2H2O,其中工作“B”为________(填“放电”或“充电”);电解质不能用浓盐酸,否则电池失效并放出大量的氯气,其原因是________(用化学方程式表示)。
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中,揽拌后溶液显紫红色。则每反应1 molMn(NO3)2,转移______________mol电子。
查看答案和解析>>
科目: 来源: 题型:
【题目】N、Cu、H、O、S、Mg是常见的六种元素。
(1)Mg位于元素周期表第______周期第______族;N与O的基态原子核外未成对电子个数比为_______;Cu的基态原子电子排布式为______。
(2)用“>”或“<”填空:
碱性:Mg(OH)2______Cu(OH)2 第一电离能:O______N
熔点:MgS______MgO 稳定性:H2S______H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为______。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目______。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,用0.10 mol·L-1的盐酸分别滴定体积相同且浓度均为0.10 mol·L-1的三种一元碱XOH、YOH 及ZOH,滴定曲线如图所示。下列说法正确的是

A. YOH 是强碱
B. V(盐酸)/V(碱)=0.5 时,c(Z+)>c(Y+ )>c(X+)
C. X++H2O![]() XOH+H+ 的平衡常数K=10-4
XOH+H+ 的平衡常数K=10-4
D. 滴定XOH 时可用酚酞作指示剂
查看答案和解析>>
科目: 来源: 题型:
【题目】对于恒容密闭容器中发生的可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为
2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为
A. 断开一个N≡N键的同时有6个N—H键生成
B. 混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D. N2、H2、NH3分子数比为1∶3∶2的状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com