
科目: 来源: 题型:
【题目】在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g)![]() zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3mol/L。则下列有关判断正确的是 ( )
zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3mol/L。则下列有关判断正确的是 ( )
A. x+y>z+m B. 混合气体的密度一定减小
C. 平衡向正反应方向移动 D. B的转化率一定减小
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实数室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。
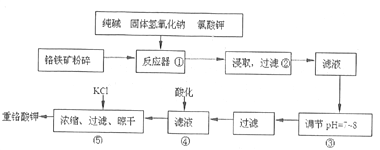
涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O。
12Na2CrO4+3Fe2O3+7KC1+12H2O。
(1)进入反应器①之前将铬铁矿粉碎的目的是____________________________。
(2)步骤②过滤得到的滤渣主要成分是_______________。过滤所需的玻璃仪器有_________________。
(3)操作④中酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_________________________。
(4)操作③调节溶液pH=7~8的目的是_________________________。
(5)工业上也常用电解法处理酸性含铬废水,用耐酸电解槽,铁板作电极,槽中盛放酸性含Cr2O72-的废水,原理示意图如下图。

B为电解池的________极,写出阳极的电极反应式____________________。阳极区域溶液中发生反应的离子方程式为____________________________________。为了使Cr3+和Fe3+转化为Fe(OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=1.0×10-12mo1·L-1,则溶液中c(Cr3+)=_________mo1·L-1。{已如Ksp[Fe(OH)3]=4.0×10-28,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇(CH3OH)重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(1)T℃时,在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。

①反应2min到5min,用氢气表示的平均反应速率v(H2)=_____________。
②下列说法正确的是_____________(填字母序号)。
A.达到平衡时,CO的转化率为50%
B.5min后容器中压强不再改变
C.达到平衡后,再充入氩气,反应速率增大
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
E.加入催化剂可以加快化学反应速率,同时提高CO和H2平衡的转化率
③下列叙述可以说明该反应在该条件下已经达到化学平衡的是__________(填字母序号)。
A.混合气体密度不发生改变 B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=2v(H2)逆 D.n(CO)与n(H2)的比值不变
(2)某温度下,在一容积可变的恒压密闭容器中分别充入1molCO和1.2molH2,达到平衡时容器体积为2L,且含有0.5molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.3molCO和0.3mo1CH3OH(g),则此平衡将______________(填“向正反应方向”、“不”或“向逆反应方向”)移动。
(3)若压强、投料比x=n(CO)/n(H2)对反应的影响如图二所示,则图中曲线所示的压强关系:p1_____p2(填“=”“>”或“<”)。
(4)工业上另一种合成甲醇的方法是利用CO2和H2,已知:CH3OH、H2的燃烧热(△H)分別为-726.9kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应不可能作为原电池工作时发生的反应的是
A. Cu+2AgNO3===Cu(NO3)2+2Ag
B. 2Fe+O2+2H2O===2Fe(OH)2
C. Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3![]() +10H2O
+10H2O
D. 2H2+O2===2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A. Fe2O3溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
B. Na2SO3与稀硝酸:SO32-+2H+=SO2↑+H2O
C. AlCl3溶液中加入足量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移8mol电子
3H2+CO,每消耗1molCH4转移8mol电子
B. 电极A上H2参与的电极反应为:H2+CO32--2e-=H2O+CO2
C. 电池工作时,CO32-向电极B移动
D. 用电器上每通过4mol电子,电极B上参加反应的O2为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):

相关信息如下表所示。
化合物 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 |
TiCl4 | -25 | 136 | 1.5 | 易水解生成难溶于水的物质,能溶于有机溶剂 |
CCl4 | -25 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为a→ → →f→g→ → →d→e→j。(填仪器接口字母)_____________
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;__________(按正确的顺序填入下列操作的序号)。
①关闭分液漏斗活塞 ②打开分液漏斗活塞
③停止加热,充分冷却 ④加热装置D中陶瓷管
(3)装置A中导管m的作用是________________。
(4)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为______________。
(5)设计实验证明装置E中收集到的液体中含有TiCl4:___________________________________。
(6)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表物质按碱、酸、盐、碱性氧化物、酸性氧化物的顺序分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
B | KOH | HCl | NaCl | CaO | CO |
C | NaOH | H2CO3 | CaCl2 | CuO | SO2 |
D | NaOH | HNO3 | BaCO3 | NO | SO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β—羰基酯,同时失去一分子醇,该反应称克莱森(R·L·Claisen)酯缩合反应,其反应机理如下:2RCH2COOC2H5![]()
 +C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:
+C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:

回答下列问题:
(1)A的名称为__________,C的结构简式为__________。
(2)F中含氧官能团的名称是__________;反应Ⅱ的反应类型是__________。
(3)E→F反应的化学方程式为_________________________________。
(4)B的含有苯环的同分异构体有_____________种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为__________、__________。
(5)乙酰乙酸乙酯( ![]() )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
查看答案和解析>>
科目: 来源: 题型:
【题目】右图为原电池示意图,回答下列问题:
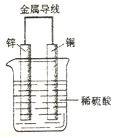
(1)该装置能够将_________能转化成电能。
(2)锌是原电池的_______极,放电过程中____(填“得”或“失”)电子,发生_______反应。
(3)电子是由_______极通过导线流向________极。
(4)铜电极的电极的反应式为____________________
(5)总反应的化学方程式为_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com