
科目: 来源: 题型:
【题目】(1)根据右图回答①②:
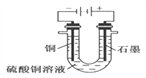
①断开 K2,闭合 K1。B 极的电极反应式为__________。
②断开 K1,闭合 K2。B 极的电极反应式为__________。
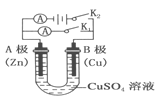
(2)根据右图回答③④:
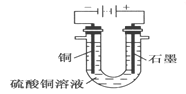
③将较纯净的CuSO4溶液放入如图2 所示的装置中进行电解电解反应的离子方程式为___________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的 NO),装置如图所示:
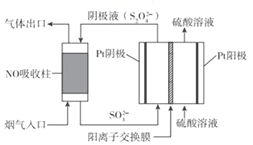
阴极区的电极反应式为_________。
(4)银锌碱性电池的电解质溶液为 KOH 溶液,电池放电时正极的 Ag2O2 (Ag 为+2价) 转化为Ag ,负极的Zn转化为K2Zn(OH)4,写出该电池总反应方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收。已知X是化石燃料燃烧产物之一,是形成酸雨的主要物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应。请写出下列物质反应的化学方程式。
(1)X在一定条件下与氧气反应____________________________________;
(2)Y与氢氧化钠溶液的反应______________________________________;
(3)Z与水的反应________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用。它的有效成份是下列物质中的一种,这种物质是
A.KMnO4B.Na2O2C.NH3·H2OD.NaClO
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
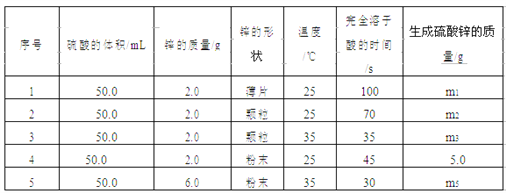
(1)本实验中实验 2 和实验 3 表明________对反应速率有影响。
(2)若采用与实验 1 完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
Ⅱ.某温度时,在 5 L 的容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
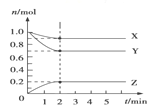
(3)反应开始至 2 min,Y 的平均反应速率_______mol/(L·min)。
(4)反应开始至 2 min,X 的转化率________。
(5)写出 X、Y、Z 的反应方程式________________。
Ⅲ.(6)C2H5OH-O2-KOH 溶液燃料电池,则负极电极反应式为________。反应进行后,溶液的 pH________(填“增大”、“减小”或“不变”)。
(7)将该反应 Fe+2FeCl3=3FeCl2 设计成原电池。则负极材料为_______,正极材料为______。正极反应式________
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列6种与人们生产生活相关的有机物:
① HCOOH(基础化工原料) ② CH3CH2COOH (防霉剂)
③ CH3CH2CH2CH3(打火机燃料) ④ ![]() (冷冻剂)
(冷冻剂)
⑤ HO—CH2—CH2—OH(汽车防冻液) ⑥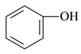 (杀菌剂)
(杀菌剂)
请回答:
(1)属于酚的是______(填序号)。
(2)与①互为同系物的是______(填序号)。
(3)与③互为同分异构体的是______(填序号)。
(4)用系统命名法给④命名,其名称为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】80℃时,2 L密闭容器中充入0.40 mol N2O4,发生如下反应:N2O4(g)![]() 2NO2(g)。一段时间后达到平衡,测得数据如下:
2NO2(g)。一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/( mol·L1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
请回答:
(1)20 s内,v(NO2) =_________mol/(L·s) 1。
(2)升高温度时,c(NO2)增大,则正反应是______(选填“放热”或“吸热”)反应。
(3)该温度下反应的化学平衡常数数值为______。
(4)该条件下N2O4的平衡转化率是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com