
科目: 来源: 题型:
【题目】已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可做钡餐,BaCO3不能作钡餐的主要理由是( )
A. BaSO4的溶度积常数比BaCO3的小
B. SO![]() 没有毒性,CO
没有毒性,CO![]() 有毒性
有毒性
C. BaSO4的密度大
D. 胃酸能与CO![]() 结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
查看答案和解析>>
科目: 来源: 题型:
【题目】科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
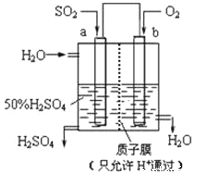
A. a为正极,b为负极
B. 生产过程中a电极质量减轻
C. 电子从b极向a极移动
D. 负极反应式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,pH=l 的某溶液 A 中除H+外,还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、 Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol·L-1。现取该溶液进行有关实验,实验结果如下图所示,下列有关说法正确的是

A. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B. 实物消耗Cu14.4g,则生成气体丁的体积为3.36L
C. 该溶液一定没有Fe3+,但是无法确定是否含有I-
D. 沉淀乙一定有BaCO3,可能有BaSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为________________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有________。
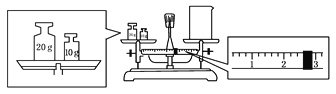
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为____________ g,要完成本实验该同学应称出____________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键是( )
A.一定形成共价键
B.一定形成离子键
C.可能形成共价键,也可能形成离子键
D.以上说法都不对
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、M为短周期主族元素,25°C时,其最高价氧化物对应的水化物(浓度均为 0.01mol.L-1)溶液的pH和原子半径的关系如图所示。下列有关说法不正确的是
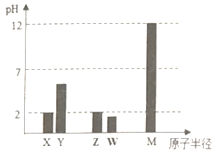
A. Y的最高价氧化物的电子式为:![]()
B. 最简单气态氢化物的热稳定性:Z>W
C. X、M两种元素形成的简单离子半径大小顺序:X<M
D. X的氢化物与Z的氢化物反应后生成的化合物中既含离子键又含共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。

(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量 | 溶液的密度 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_____mol·L-1。
(3)物质的量浓度为c2mol·L-1的氨水与![]() c2mol·L-1的氨水等质量混合,所得溶液的密度_____ (填“大于”、“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度_____
c2mol·L-1的氨水等质量混合,所得溶液的密度_____ (填“大于”、“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度_____![]() c2mol·L-1(设混合后溶液的体积变化忽略不计)。
c2mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在元素周期表中,A、B均为前四周期主族元素,且A位于B的下一周期。某含氧酸盐X的化学式为ABO3。请回答:
(1)若常温下B的单质为黄绿色气体。
①A在元素周期表中的位置是_______________________。
②下列说法正确的是_________(填代号)。
a.A单质的熔点比B单质的熔点低
b.A的简单离子半径比B的简单离子半径大
c.A、B元素的最高价氧化物对应的水化物都是强电解质
d.化合物X中既含有离子键又含有共价键
③400℃时,X能发生分解反应生成两种盐,其物质的量之比为1∶3,其中一种是无氧酸盐。该反应的化学方程式为_____________________________________________。
(2)若X能与稀硫酸反应,生成无色、无味的气体。
①该气体分子的电子式为______________________。
②X在水中持续加热,发生水解反应,生成一种更难溶的物质并逸出气体,反应的化学方程式为__________________________________________。
③X可用作防火涂层,其原因是:a.高温下X发生分解反应时,吸收大量的热;
b. __________________________________________(任写一种)。
(3)若X难溶于水,在空气中易氧化变质,B元素原子的最外层电子数是其电子层数的2倍。X能快速消除自来水中的C1O-,该反应的离子方程式为______________________________________。
(4)用一个化学方程式证明上述(1)、(3)两种情况下化合物X中B元素非金属性强弱________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,固定容器中,无论以何比例混合,其密度都不变的是
A. CH4 和 C2H4 B. C3H6和 CO2
C. C2H6和 C2H4 D. CO和C2H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com