
科目: 来源: 题型:
【题目】五氧化二钒在工业生产中有重要用途。某含钒废料的成分为V2O5、V2O4、SiO2、Fe2O3、Al2O3,实验小组从其中回收V2O5的一种工艺流程如下:
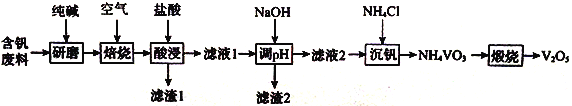
请回答下列问题;
(1)(研磨)的目的为__________________。所加纯碱不宜过量太多,理由为_________。
(2)“焙烧”后所得混合物中除含Na2CO3、NaVO3、Fe2O3、NaA1O2外,还含有________(填化学式)。
(3)“酸浸”时,VO3-转化为VO2+,转化反应的离子方程式为_________________________;滤渣1的主要成分为_________________(填化学式)。
(4)已知:常温下,Al(OH)3、Fe(OH)3 饱和溶液中金属阳离子浓度的负对数[-lg c(M3+ )]与pH 的关系如图所示:
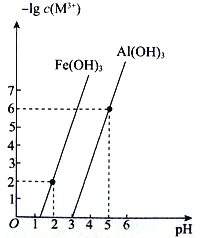
常温下,Ksp[Fe(OH)3]=________________________;当调pH=4 时,溶液中A13+________(填“是”或“否”)沉淀完全。(已知;溶液中离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全)
(5)“煅烧”时,反应的化学方程式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组测定某蛋白质的组成(假定只含C、H、O、N元素),设计如下实验(夹持装置略去)。
I.样品中碳、氢含量的测定

(1)仪器a的名称为___________________________。
(2)导管g的作用为______________________________________。
(3)选择上述装置,按气流从左到右的方向,合理的连接顺序为____________________(填大写字母,仪器可重复使用)→排水法收集气体装置。
(4)称取4.65g蛋白质样品,用上述连接好的装置进行实验。
①充分反应后,熄灭D处酒精灯之前,需继续通入O2至硬质玻璃管冷却,原因为__________________。
②充分反应后,测得用于接收气体产物的碱石灰和P2O5分别增重7.7g、2.25g。
Ⅱ.样品中氮元素含量的测定
已知:在催化剂存在下,浓硫酸能将样品中的氮元素转化为铵盐。
i.重新称取4.65g蛋白质样品,将其中的氮元素全部转化为铵盐;
ii.所得铵盐与足量NaOH溶液反应,并用100mLl mol·L-l盐酸将生成的氨气全部吸收;
iii.将吸收液稀释至500mL;
iv.取25.00mL稀释后的溶液,用0.1000 mol·L-l的NaOH溶液平行滴定,平均消耗标准液25.00mL。
(5)蛋白质样品中C、H、N、O的原子数目之比为_____________________。若步骤iii中定容时仰视容量瓶刻度线,则所测氮元素含量___________(填“偏高”“偏低”或“无影响”)。
(6)有同学认为,通过(3)中收集到的气体体积即可得到氮元素的含量,你认为其观点___________(填“正确”或“不正确”),理由为________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,并用单线桥法标出电子转移的方向和数目:_____________。该反应中,________是还原剂,________是还原产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④在反应中每生成1 mol H2O转移1 mol电子
(3)在反应2H2S+SO2![]() 3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
查看答案和解析>>
科目: 来源: 题型:
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡,下列说法不正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法不正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为放热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)>c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
查看答案和解析>>
科目: 来源: 题型:
【题目】两个体积相同的容器,一个盛有NO,另外一个盛有N2和O2,在标准状况下两容器内的气体一定具有相同的( )
①原子总数;②质子总数;③分子总数;④质量
A.①②B.②④C.②③D.①③
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25℃时,0.1mol·L-lCH3COOH的电离度(已电离的CH3COOH分子数/原CH3COOH分子总数)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00 mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法正确的是

A. M点→N点,水的电离程度逐渐增大
B. 25℃时,CH3COOH 的电离常数约为1.0×10-2
C. N点溶液中,c(CH3COO-) =c(NH4+)=0.05 mol·L-l
D. 当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
科目: 来源: 题型:
【题目】锂硫电池是一种新型储能电池,放电时的总反应为2Li+xS=Li2Sx。以该电池为电源制备甲烷的原理如图所示。
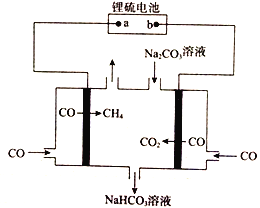
下列说法正确的是
A. b为锂硫电池的负极
B. 锂硫电池的正极反应式为Li-e-=Li+
C. 阳极反应式为CO+3CO32-+2H2O-2e-==4HCO3-
D. 该装置工作时溶液中的CO32-增大
查看答案和解析>>
科目: 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
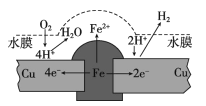
A. 腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B. 若水膜中溶有食盐将加快铁铆钉的腐蚀
C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D. 若将该铜板与直流负极相连,则铁铜均难被腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,分子数相同的是( )
A.2L SO2和2L CO2B.标准状况下1mol氧气和22.4L水
C.9g水和标准状况下11.2L CO2D.0.2molH2S和2.24LHCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com