
科目: 来源: 题型:
【题目】(1)维生素C又称为抗坏血酸,在人体内有重要的功能。例如,帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+。这说明维生素C具有________(填“氧化性”或“还原性”)。
(2)2Na+O2![]() Na2O2反应中,
Na2O2反应中,
①________被氧化,________是氧化剂,氧化产物是_______,过氧化钠中氧元素的化合价是_______。
②此反应中若转移了2 mol的电子,则需要氧气________ mol。
③用单线桥或双线桥法表示反应中电子转移的方向和数目:______________________。
(3)根据反应①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是____________。
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)从氧化还原的角度分析水在下列化学反应中的作用(从氧化剂、还原剂角度分析)。
①电解水:_____________________________________________________。
②钠和水的反应(2Na+2H2O=2NaOH+H2↑):_______________________________。
③氟气和水反应(2F2+2H2O=4HF+O2):_______________________________。
④氯气和水反应(Cl2+H2O=HCl+HClO):______________________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应体系中还原产物是________;若反应中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl,这个事实说明具有还原性的粒子还原性强弱顺序为____________。足量Cl2通入FeBr2溶液中发生反应的离子方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)基态Co原子核外电子占据_________种不同的能级,其中有__________个未成对电子。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ键的数目为_____________________。
②与CNO-互为等电子体的分子为_______________(填化学式,任写一种)
③C、N、O三种基态原子的第一电离能由大到小的顺序为___________(用元素符号表示)。
④相同压强下,CO晶体的熔点高于N2晶体的原因为____________________________。
(3)多硼酸根的结构之一为链状(如图1),化学式为______________,其中B原子的杂化形式为______________。

(4)BN晶体有多种结构,其中立方氮化硼具有金刚石型结构(如图2)。
①晶体的最小环中含有____________个B原子。
②若晶胞参数为anm,晶胞密度为ρg·cm-3,则阿伏加德罗常数的值可表示为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向某HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )

A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】TiO2和TiCl4均为重要的工业原料。已知:
Ⅰ.TiCl4(g)+O2(g)![]() TiO2(s)+2Cl2(g) ΔH1=-175.4kJ·mol-1
TiO2(s)+2Cl2(g) ΔH1=-175.4kJ·mol-1
Ⅱ.2C(s)+O2(g)![]() 2CO(g) ΔH2= -220.9kJ·mol-1
2CO(g) ΔH2= -220.9kJ·mol-1
请回答下列问题:
(1)TiCl4(g)与CO(g)反应生成TiO2(s)、C(s)和氯气的热化学方程式为_____________________。升高温度,对该反应的影响为___________________________________。
(2)若反应Ⅱ的逆反应活化能表示为EkJ·mol-1,则E________220.9(填“>”“<”或“=”)。
(3)t℃时,向10 L恒容密闭容器中充入1molTiCl4和2 molO2,发生反应Ⅰ。5min达到平衡时测得TiO2的物质的量为0.2 mol。
①0~5 min 内,用Cl2表示的反应速率v(Cl2)=__________。
②TiCl4的平衡转化率a=__________________。
③下列措施,既能加快逆反应速率又能增大TiCl4的平衡转化率的是__________(填选项字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分TiO2 D.增大O2浓度
④t℃时,向10 L恒容密闭容器中充入3 mol TiCl4和一定量O2的混合气体,发生反应Ⅰ,两种气体的平衡转化率(a)与起始的物质的量之比(![]() )的关系如图所示:
)的关系如图所示:
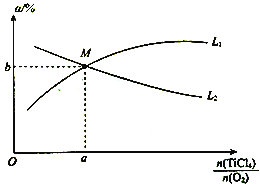
能表示TiCl4平衡转化率的曲线为__________(填“L1”或“L2”);M点的坐标为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)根据反应8NH3+3Cl2![]() 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是______________,氧化产物是___________________。
②该反应中被氧化的物质与被还原的物质物质的量之比为________________。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是__________,还原剂是___________。
②该反应中1 mol氧化剂____________(填“得到”或“失去”)____________mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是__________L。
④请把各物质填在下面空格处,需配平:
□______+□______=□______+□______+□______+□
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com