
科目: 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( )
A. v(A)=0.5molL﹣1.mim﹣1
B. v(B)=0.3molL﹣1.mim﹣1
C. v(C)=0.8molL﹣1.mim﹣1
D. v(D)=1.0molL﹣1.mim﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe2O3+2Al![]() Al2O3+2Fe所属基本反应类型是______。在该反应中______元素的化合价升高,该元素的原子______电子,被______。该反应中,Fe2O3发生了________反应,Al发生了______反应,______是氧化剂,__是还原剂,______是氧化产物,_____是还原产物。
Al2O3+2Fe所属基本反应类型是______。在该反应中______元素的化合价升高,该元素的原子______电子,被______。该反应中,Fe2O3发生了________反应,Al发生了______反应,______是氧化剂,__是还原剂,______是氧化产物,_____是还原产物。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组的几种分子中所有原子都可能处于同一平面的是
A.CH4、CS2、BF3 B.CO2、H2O、NH3
C.C2H4、C2H2、C6H6 D.CCl4、BeCl2、PH3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 苯与浓硝酸、浓硫酸共热并保持 70~80 ℃反应生成硝基苯
B. 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于苯环对侧链的影响,使侧链易被氧化
C. 若甲苯苯环上的一个氢原子被一个含 3 个碳原子的烷基取代,所得产物有 6 种
D. 菲的结构简式为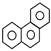 ,它与硝酸反应,可生成 5 种一硝基取代物
,它与硝酸反应,可生成 5 种一硝基取代物
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A. V(NaOH)=0时,c(H+)=1×10-2mol/L
B. V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C. V(NaOH)=10mL时,c(H+)=1×10-7mol/L
D. V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)许多金属元素有焰色反应,金属存在焰色反应的原因是___________________________。
(2)基态铝原子中,有______种电子运动状态,其中p轨道的电子云轮廓图的形状为_______。
(3)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
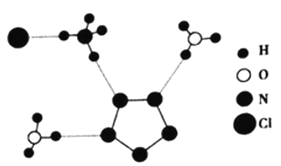
①图中R中阳离子是______(填写化学式),相对分子质量较大的阳离子中心原子的杂化类型是____。
②图中R中阴离子N5-中的σ键总数为___________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N5- 中的大π键应表示为___________。
),则N5- 中的大π键应表示为___________。
(4)氮与铝之间形成化合物X,具有耐高温抗冲击等性能。X的晶体结构如图所示。
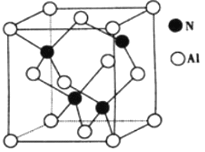
①已知氮化硼与X晶体类型相同,推测氮化硼的熔点比X的熔点___________(填“高”、“低“ ) ,可能的原因是_________________________________________。
②若X的密度为ρg·cm-3,则晶体中最近的两个Al原子的距离为___________cm。(阿伏加德罗常数的值用NA表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】第VA族元素单质及其化合物在生产、生活中有重要的用途。
(1)下列说法正确的是__________(填序号)。
a.含氧酸的酸性:HNO3>H3PO4>H3AsO4 b.原子半径:S >P>As
c.氢化物的稳定性NH3>PH3> AsH3d.AsH3电子式是![]()
(2)雌黄(As2S3 )和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
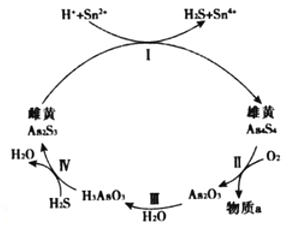
①Ⅱ中若1molAs4S4反应转移28mole-,a物质是__________。
②Ⅰ中反应的离子方程式是____________________________________。
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示。

①人体血液的pH在7.35~7.45 之间,用药后人体中含砷元素的主要微粒是___________。
②H3AsO3的一级电离常数是6×10-10mol·L-1,n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液的pH=___________(列出计算式即可)。
(4)由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图所示:

①“浸出”时Bi2S3与FeCl3 溶液反应的离子方程式为________________________________。
②“置换”时生成单质铋的离子方程式为____________________________________。
③“粗秘”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,其装置示意图如所示。电解后阳极底部留下的为精铋。写出阳极电极反应的方程式__________________________。
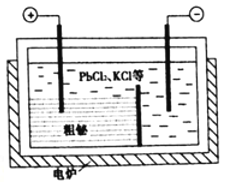
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是
A.1mol·L-1 KCl溶液中含有的氯离子数目为NA
B.常温常压下16gO2与16gO3含有的氧原子数目相等
C.标准状况下,22.4LH2O含有的原子数目为3NA
D.18gNH4+所含电子数为11NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com