
科目: 来源: 题型:
【题目】下列各个反应,不能用于工业生产的是
A. 二氧化锰和浓盐酸共热制氯气 B. 煅烧黄铁矿(FeS2)制SO2
C. 氯气与石灰乳反应制漂白粉 D. 电解熔融氯化镁制金属镁
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液: c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 含有AgCl和AgI固体的悬浊液: c(Ag+)>c(Cl-)=c(I-)
C. CO2的水溶液:c(H+)>c(HCO![]() )=2c(CO
)=2c(CO![]() )
)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
![]()
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】(1)称取 g草酸晶体(H2C2O4·2H2O),配置500 mL 0.10 mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
B.定容时俯视刻度线 |
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
实验 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L | 等浓度 | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/LK2SO4溶液 | 18 |
则x = ,假设2成立
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10 mol/L H2C2O4溶液于锥形瓶中,加入10 mL 0.50 mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。上述实验中KMnO4溶液的物质的量浓度为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】按照物质的树状分类和交叉分类,HNO3属于( ) ①酸②氢化物③氧化物④含氧酸⑤难挥发性酸⑥一元酸⑦化合物⑧混合物.
A.①②③④⑤⑥⑦
B.①④⑥⑦
C.①⑧
D.①④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用MnO2和浓盐酸在加热条件下反应制取Cl2。下列说法正确的是
A. 反应中HCl既表现酸性,又表现还原性
B. 用饱和碳酸氢钠溶液可除去Cl2中的HCl
C. 用NaOH溶液吸收Cl2,反应中Cl2只作氧化剂
D. 将湿润的有色布条伸入集满Cl2的集气瓶中,布条褪色说明Cl2具有漂白性
查看答案和解析>>
科目: 来源: 题型:
【题目】铈是地壳中含量最高的稀土元素,二氧化铈(CeO2)是其重要的化合物。平板液晶显示屏生产过程中产生大量的废玻璃粉末,其中含CeO2、SiO2、Fe2O3等物质,某实验小组以此粉末为原料回收铈,设计流程如图所示:
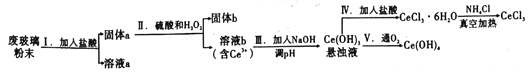
(1)步骤Ⅰ加入过量盐酸后,溶液a中的阳有离子___________________。
(2)步骤Ⅱ中反应的氧化剂和还原剂的物质的量之为___________。
(3)为了使步骤Ⅲ所得悬浊液中的Ce3+浓度为1×10-6mol·L-1,则加入NaOH调节溶液的pH应为____________[已知:Ce(OH)3的Ksp=8.0×10-21,lg2=0.3]。
(4)将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中加入NH4Cl的作用是__________。
(5)第Ⅴ步反应的化学方程式是____________________;用反应得到的悬浊液制备纯净的Ce(OH)4需进行的实验操作为______________。
(6)对CeCl3样品纯度进行测定的方法:准确称取样品wg配成100mL溶液,取25.00mL置于锥形瓶中,加入稍过量的过二硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+,然后用萃取剂[用(HT2)表示]萃取Ce4+,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(其离子反应方程式为Ce4++Fe2+=Ce3++Fe3+),重复2~3次,平均消耗VmL标准溶液。
①“萃取”时存在反应:Ce4++n(HT)2![]() Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
②经计算,CeCl3样品的纯度为________________。 [M(CeCl3)=246.5g·mol-1]
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年以来我国北方的“雾霾”污染日益严重。中科院“大气灰霾追因与控制”项目针对北京强霾过程进行分析,强霾过程中,出现了大量有毒有害的含氮有机颗粒物。燃煤和机动年尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②OCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
③H2O(g)=H2O(1)△H=-44.0kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________________________。
(2)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程中NO的物质的量随时间变化如下图所示。

①写出该反应的化学方程式:________________________________。
②10min内该反应的速率v(N2)=___________;该反应达平衡时CO的转化率为___________;T℃时该化学反应的平衡常数K=___________。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是________。

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再改变
c.2v正(NO)=v逆(N2) d.气体的密度保持不变
(3)以燃料电池为代表的新能源的推广“使用能大大降低污染物的排放。如图是一种甲醚燃料电池结构,请写出该电池负极的电极反应式:________________________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠和水反应Na+H2O=Na++OH-+H2↑
B.碳酸钙与稀盐酸反应:2H++CO32-=CO2↑+H2O
C.氯气溶于水的离子方程式为Cl2+H2O2H++Cl-+ClO-
D.碳酸氢钠溶液中加入醋酸:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的分离方法不正确的是( )
A.用蒸馏的方法将自来水制成蒸馏水
B.用过滤的方法除去食盐水中的泥沙
C.用淘洗的方法从沙里淘金
D.用酒精萃取碘水中的碘
查看答案和解析>>
科目: 来源: 题型:
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
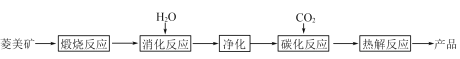
(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com