
科目: 来源: 题型:
【题目】下列说法正确的是:
A. 分子式为C7H8,分子中含有苯环的烃的一氯代物有4种
B. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
C. 如图所示实验可证明元素的非金属性:Cl>C>Si

D. C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点正丁烷低于异丁烷
查看答案和解析>>
科目: 来源: 题型:
【题目】在 t℃时, Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知 AgCl 的Ksp=1.8×10-10。下列说法不正确的是( )
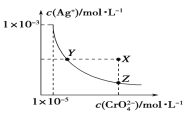
A. t℃时,Ag2CrO4的 Ksp为 1×10-8
B. t℃时,Y 点和Z点时 Ag2CrO4的 Ksp 相等
C. t℃时,Ag2CrO4、AgCl 饱和溶液中,前者 c(Ag+)大
D. 饱和 Ag2CrO4 溶液中加 K2CrO4 不能使溶液由 Y点变为 X点
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp[Fe(OH)3]=2.6×10-39,回答下列问题:
(1)FeCl3溶液可用做净水剂,其净水原理为(用离子方程式表示):______________________。
(2)某酸性MgCl2溶液中含有少量FeCl3,为得到纯净的MgCl2溶液,可加入___________调节溶液的pH=4,使溶液中的Fe3+变为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________________。
(3)由FeCl3·6H2O晶体得到纯的无水FeCl3的合理方法是:______________________________。
(4)草酸亚铁是制备高纯度活性铁粉的原料,其样品纯度测定步骤如下:准确称取草酸亚铁(FeC2O4)样品wg,将其研成粉末后溶于适量的稀硫酸中(假设杂质不反应)配成250omL溶液。准确量取20mL该溶液于锥形瓶中,用cmol/L的K2Cr2O7酸性溶液(用稀硫酸酸化)滴定至终点,消耗滴定液VmL(还原产物为Cr3+,氧化产物为Fe3+和CO2)。
①滴定时反应的离子方程式为____________________________________。
②该草酸亚铁样品的纯度为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1 mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 对于A(s)+B(g) ![]() C(g)+D(g)的反应,加入A,反应速率加快
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2![]() N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g) ![]() 2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
查看答案和解析>>
科目: 来源: 题型:
【题目】某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①少量澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是
A.一定没有CO2,肯定有H2
B.一定有CO、CO2和水蒸气
C.可能有CO2、NH3和水蒸气
D.一定有H2、CO2和HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是:
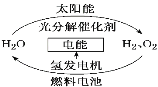
A. H2O的分解反应是放热反应
B. 氢能源已被普遍使用
C. 2 mol液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D. 氢氧燃料电池放电过程中是将电能转化为化学能
查看答案和解析>>
科目: 来源: 题型:
【题目】下列括号中的物质是除去杂质所需的药品或操作,其中错误的是
A.NaCl溶液中有杂质Na2SO4(氯化钡)B.FeSO4溶液中有杂质CuSO4(铁粉)
C.生石灰中混有少量石灰石(高温煅烧)D.CO2中有少量CO(灼热的氧化铜)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g)![]() 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。

实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,.实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
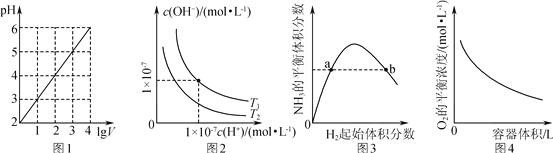
A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com