
科目: 来源: 题型:
【题目】工业合成氨反应:N2+3H2 ![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可___(填“吸收”或“放出”)热量___kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是_______________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为_____mol/(L·min)。
(4)一定条件下,当合成氨反应达到化学平衡时,下列说法正确的是________
A.正反应速率和逆反应速率相等 B.正反应速率最大,逆反应速率为0
C.N2的转化率达到最大值 D.N2和H2的浓度相等
E.N2、H2和NH3的体积分数相等 F.反应达到最大限度
查看答案和解析>>
科目: 来源: 题型:
【题目】具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-![]() FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是
FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是

A.电解一段时间后,阳极室的c(OH-)增大
B.Na+由阴极室移向阳极室
C.阴极反应式:2H2O+2e-=H2↑+2OH-
D.电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用Fe2(SO4)3酸性溶液处理SO2废气的工艺流程如下,下列说法不正确的是)

A.溶液的pH:①>②>③
B.整个过程中Fe2(SO4)3溶液可以循环利用
C.溶液②转化为溶液③发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O
D.向②溶液中滴加KSCN溶液,溶液可能变为血红色
查看答案和解析>>
科目: 来源: 题型:
【题目】向1 L的密闭容器中加入1 mol X、0.3 mol Z和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
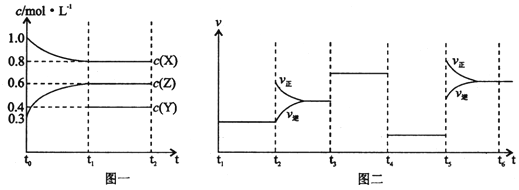
A.Y的起始物质的量为0.5 mol
B.该反应的化学方程式为:2X(g)+Y(g) ![]() 3Z(g) H<0
3Z(g) H<0
C.若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L·s)
D.反应物X的转化率t6点比t3点高
查看答案和解析>>
科目: 来源: 题型:
【题目】已知a—淀粉酶的最适温度为60℃,某同学为了探究pH对a—淀粉酶活性的影响,在35℃和45℃两个温度条件下分别设置了7支试管,每支试管中均加入4 mL淀粉溶液(淀粉的初始含量为yo g),然后加入pH缓冲液,设置pH值分别为1.0、3.0、5.0、7.0、9.0、11.0、13.0,再加入2 mL a—淀粉酶溶液,反应3 min盾迅速在每支试管中同时加入足量的NaOH溶液,测定每支试管中的淀粉的剩余量,得到如图所示的曲线。请回答下列问题:
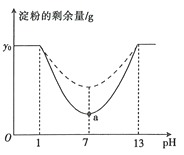
(1)反应3 min后迅速加入足量的NaOH溶液的目的是 。该同学认为反应时间过长或加入的淀粉量少都可能导致实验失败,其依据是酶的催化具有____的特点。
(2)分析图中数据可知,实线部分表示在温度为 条件下测定的结果;使a—淀粉酶完全失活的pH范围为 ;图中a点限制酶促反应速率的外界因素主要是____。
(3)若该同学在某pH条件下测定淀粉的剩余量为y1 g,则用淀粉的消耗速率表示该条件下促反应速率为 g/min。
查看答案和解析>>
科目: 来源: 题型:
【题目】在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层称作为电子层。电子层模型被称为洋葱式结构,如图所示:
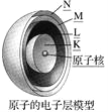
根据电子层模型,判断下列说法不正确的是( )
A. 多电子原子的核外电子是分层运动的
B. 所有电子在同一区域里运动
C. 排在K、L、M层上的电子的能量依次增大
D. 多电子原子里电子的能量不同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作正确的是( )
A.将浓硫酸转移至容量瓶中,加水稀释至距标线2~3 cm处,改用胶头滴管定容
B.用酒精萃取碘水中的碘单质
C.进行液体蒸馏实验时,冷凝管中应充满自来水
D.某溶液加入盐酸酸化的氯化钡溶液后,出现白色沉淀,则原溶液中必有SO42﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
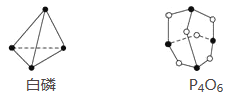
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目: 来源: 题型:
【题目】天然食用香料X是芳香族化合物,可以从某些植物中提取。由x合成H的路线如下:
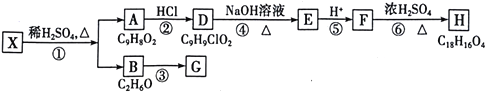
已知:①A的核磁共振氢谱有6个峰;②H为酯类物质,结构中除苯环外还含有一个六元环;③G的产量是衡量一个国家石油化工发展水平的标志。
请回答下列问题:
(1)A的结构简式为_____________________________。
(2)⑥的反应类型为___________________,反应③的化学方程式为___________________________。
(3)F中所含官能团的名称为_________________,其同分异构体中,遇FeCl3溶液发生显色反应,且能与碳酸氢钠溶液反应,其苯环上一氯代物只有一种,符合条件的同分异构体数目为______种,写出其中一种结构简式__________________________________。
(4)设计一条以G为起始原料合成乙二酸的路线________________(无机物任选,注明反应条件),示例如下:
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(2) ~ (3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答。
族 周期 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | F | H | I |
(1)表中元素,化学性质最不活泼的原子结构示意图是___________,非金属性最强的元素在周期表中的位置是__________________________,
(2)最高价氧化物的水化物中碱性最强的是_________,酸性最强的是___________,
(3)A分别与D、E、G形成的最简单化合物中,最不稳定的_______________,
(4)A和E组成最简单化合物的电子______________
(5)在B、C、F、G的简单离子中,离子半径由大到小的顺序是__________________,
(6)由A的单质与O2构成的燃料电池中,在E的最高价氧化物对应水化物的条件下进行,写出正极的电极反应式______________________________________。
(7)当B的最高价氧化物的水化物与C的最高价氧化物反应后,向所得溶液中通入过量D的最高价氧化物的离子方程式___________________________________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com