
科目: 来源: 题型:
【题目】25℃时,三种难溶银盐的Ksp与颜色如右表,下列说法正确的是
AgCl | Ag2CrO4 | AgI | |
颜色 | 白 | 砖红 | 黄 |
Ksp | 1.8×10-10 | 1.0×10-12 | 8.5×10-17 |
A.AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小
B.Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol·L-1
C.向AgCl悬浊液加入足量KI溶液,沉淀将由白色转化为黄色
D.向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】H2Y为二元弱酸,酸式盐NaHY的水溶液c(OH-)>c(H+),下列叙述正确的是
A. H2Y的电离方程式:H2Y![]() 2H+ +Y2-
2H+ +Y2-
B. HY-的水解方程式:HY- + H2O![]() H3O+ + Y2-
H3O+ + Y2-
C. 该酸式盐溶液中离子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H+)
D. 该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
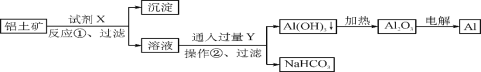
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中需要配制2molL﹣1的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950 mL;111.2 g
B.1000 mL;117 g
C.500 mL;117 g
D.1000 mL;111.2 g
查看答案和解析>>
科目: 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
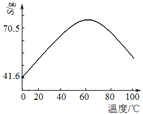
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H++OH-向右移动且溶液呈酸性的是
H++OH-向右移动且溶液呈酸性的是
A. 向水中加入NaHSO4溶液 B. 将水加热到100℃,使pH=6
C. 向水中加入Na2CO3溶液 D. 向水中加入Al2(SO4)3固体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各溶液中,Cl-物质的量浓度最大的是( )
A.5L 0.4mol·L-1 NaCl溶液B.4L 0.5mol·L-1 MgCl2溶液
C.1L 0.3mol·L-1 AlCl3溶液D.10L 0.5mol·L-1 NaCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】白钠镁矾(mNa2SO4·nMgSO4·xH2O)俗称硝板,工业上用白钠镁矾制备碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]晶须的过程如下:向碳酸钠溶液中加入白钠镁矾,保持50℃加热0.5h,有大量的5MgCO3·3H2O生成,然后升高温度到85℃加热2h发生热解反应,过滤得碱式碳酸镁晶体。
(1)热解反应的方程式为________________。
(2)碱式碳酸镁可用作化学冷却剂,原因是________________。
(3)为测定白钠镁矾的组成,进行下列实验:
①取白钠镁矾3.340 g溶于水配成100.00 mL溶液A;
②取25.00 mL溶液A,加入足量的氯化钡溶液,得BaSO4 1.165 g;
③另取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+(离子方程式为Mg2+ + H2Y2-=MgY2-+ 2H+),滴定至终点,消耗标准溶液25.00 mL。通过计算确定白钠镁矾的化学式(写出计算过程)。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】在两个隔热恒容的密闭容器中进行下列两个可逆反应:甲中:C(s)+H2O(g) ![]() CO(g)+H2(g);乙中:CO(g)+H2O(g)
CO(g)+H2(g);乙中:CO(g)+H2O(g) ![]() CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组分浓度相等 ④反应体系中温度保持不变 ⑤断裂氢氧键反应速率等于断裂氢氢键反应速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水的质量与生成氢气的质量之比为9∶1 ⑧同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明甲、乙容器中反应都达到平衡状态的是
CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组分浓度相等 ④反应体系中温度保持不变 ⑤断裂氢氧键反应速率等于断裂氢氢键反应速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水的质量与生成氢气的质量之比为9∶1 ⑧同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明甲、乙容器中反应都达到平衡状态的是
A. ④⑤⑧ B. ③④⑥ C. ⑥⑦⑧ D. ①②⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g) ![]() cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
A. 平衡正移 B. Z的体积分数变小
C. (a+b)>(c+d) D. X的转化率变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com