
科目: 来源: 题型:
【题目】某同学用50 mL 0.50mol·L-l盐酸与50 mL 0.55 mol·L-1NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量并计算中和热,回答下列问题:
(1)该实验小组做了三次实验,每次取溶液各50 mL,并将实验数据记录如下:
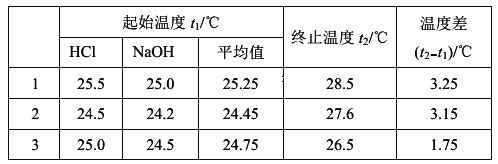
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4. 2×10-3kJ/(g·℃),则该反应的中和热△H=__________。
(2)若用50 mL 0.55 mol·L-1的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会____(填“偏小”、“偏大”或“不变”),其原因是___________________________________。
(3)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_____________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】铁制品容易生锈,对钢铁制品防腐措施合理的是
A. 暂时不使用的铁锅涂上油 B. 铁质自来水管缠上铜线
C. 铜铁帽的防护栏涂上油漆 D. 自行车钢圈镀铬
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A. 该温度高于25℃
B. 由水电离出来的H+的浓度是1.0×10-10mol·L-1
C. NaHSO4晶体的加入抑制了水的电离
D. 该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家对一碳化学进行了广泛深人的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器___________。(填序号,下同);平衡常数最小的是容器_____________。
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中![]() 与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。
与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。

a.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
d.CO还原PbO2的反应△H>0
(4)工业废水中含有甲醛,该厂降解甲醛的反应机理如图3所示,则X表示的粒子是_____,总反应的化学方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A. 该溶液的pH=4 B. 升高温度,溶液的pH和电离平衡常数均减小
C. 此酸的电离平衡常数约为1×10-7 D. 加入少量纯HA,电离程度减小电离平衡常数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃) Ag2SO4:0.796 g
(1)甲同学的实验如表:
序号 | 操作 | 现象 |
实验Ⅰ | 将2mL 1 molL-1 AgNO3溶液加入到1mL 1 molL-1 FeSO4溶液中 | 产生白色沉淀,随后又有黑色固体产生 |
取上层清液,滴加KSCN溶液 | 溶液变红 |
注:经检验黑色固体为Ag。
①白色沉淀的化学式是__________________。
②甲同学得出Ag+氧化了Fe2+的依据是_____________________________________。
(2)乙同学为探究Ag+和Fe2+的反应,进行实验II。
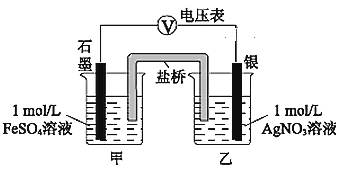
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
①盐桥中盛有饱和KNO3溶液,此盐桥中钾离子向________(填“甲”或“乙”)池移动;
②若该电池能维持稳定电流强度为1 A,工作600s,理论上Ag电极的质量会________(填“增重”或“溶解”) ________g(已知F=96500 C·mol-1,电量(C)=电流(A)×时间(s) )。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
③a中甲烧杯里的电极反应式是______________。
④b中电压表指针逆向偏移后,银为_______(填“正”或“负”)极。
(3)由上述实验得出的结论为_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):

3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
②废气中的CO2转化为甲醇可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。该燃料电池中通入甲醇的一极为____(填a或b),当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。

(2)H2还原法可消除氮氧化物
已知: N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8kJ·mol-1
①在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________。
② 以H2(g)为燃料可以设计氢气燃料电池,该电池以稀NaOH作电解质溶液,其负极电极反应式为___________________________________________________________,已知该电池的能量转换效率为86.4%,则该电池的比能量为________kW·h·kg-1(结果保留1位小数,比能量=![]() ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。
(3)微生物燃料电池(MFC)是一种现代化的氨氮去除技术。下图为MFC碳氮联合同时去除的示意图。

①已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式____________________________________________。
②解释该装置去除NH4+的原理_______________________________________________。
(4)利用“ Na—CO2”电池可将CO2变废为宝。

我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料(反应前两电极质量相等),总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为______________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com