
科目: 来源: 题型:
【题目】将体积均为5 mL的甲、乙、丙三种液体依次沿试管壁缓缓滴入试管中(勿振荡),出现如图所示的实验现象,则甲、乙、丙的组合可能是( )
![]()
选项 | A | B | C | D |
甲 | 1,2二溴乙烷 | 溴苯 | 水 | 乙醇 |
乙 | 水 | 液溴 | 大豆油 | 乙酸 |
丙 | 苯 | 乙醇 | 溴水 | 乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】在25 ℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)=________ L,V(H2)=________ L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________。
(3)若剩余气体的体积为a L,则a的取值范围是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下所示
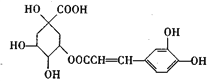
关于咖啡鞣酸的下列叙述不正确的是
A. 分子式为C16H18O9
B. 所有碳原子不可能都在同一平面上
C. 1mol咖啡鞣酸与浓溴水反应时最多可消耗5 molBr2
D. 在一定条件下可以发生取代反应、加成反应和消去反应
查看答案和解析>>
科目: 来源: 题型:
【题目】一种第二代抗组胺药物的中间体G的合成路线如下:
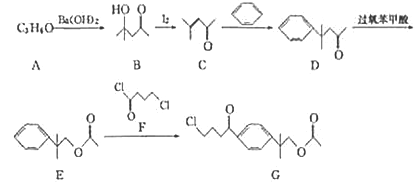
已知:A的分子结构中含有2个甲基。
回答下列问题:
(1)A的名称为__________,由A生成B的反应类型为_______。
(2)G中含氧官能团名称为_______。
(3)F的分子式为_______。
(4)由C生成D的化学方程式为______________。
(5)对二取代芳香化合物W是E的同分异构体,W能发生银镜反应和水解反应,水解产物之一能与FeCl3溶液发生显色反应,则W有________种结构,其中核磁共振氢谱为五组峰,且峰面积之比为1:2 : 2 : 2:9的结构简式为_____________。
(6)参照上述合成路线,以乙醛为原料(无机试剂任选),设计正丁醇的合成路线:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,有甲、乙两份体积均为1L、浓度均为0.1mol·L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释到100L时,溶液的pH变为x;②乙与等体积、浓度为0.2mol·L-1的NaOH溶液混合,在混合液中:n(CH3COO-)+n(OH-)-(H+)=y mol。x、y的正确答案组合为
A. 3<x<5、0.2 B. 3<x<5、0.1 C. 3、0.1 D. 5、0.2
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________(填字母)。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面(____)
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水(____)
(4)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。(填字母)
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。

(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为__________________。
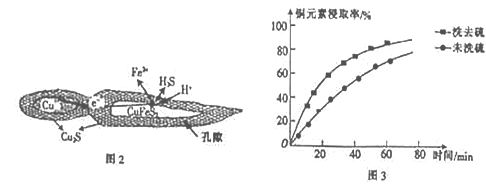
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为______;浸取时,在有氧环境下可维持Fe2+较高浓度,有关反应的离子方程式为________。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3 所示,未洗硫时铜元素浸取率较低,其原因是_____________________。
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4 所示,当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe2+萃取率降低的原因是_________________。
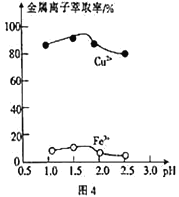
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为_______________。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、_____等操作可得到Fe2O3产品。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时在五份蒸馏水中分别加入适量的下列物质,所得实验结果如下表所示:
加入物质 | HCl(aq) | FeCl3 | NaOH | HCOONa | C2H5OH |
溶液的pH | 3 | 4 | 10 | 11 | 未测定 |
水的电离程度 | α1 | α2 | α3 | α4 | α5 |
加入物质后水的电离程度由大到小排列顺序正确的是
A.α3>α1>α5>α2>α4 B.α4>α2>α5>α1>α3
C.α4>α2>α5>α3>α1 D.α1>α3>α5>α2>α4
查看答案和解析>>
科目: 来源: 题型:
【题目】利用H2还原铁的氧化物并确定其组成的装置如图所示(Zn粒中往往含有硫化物等杂质,焦性没食子酸溶液可吸收少量氧气)。
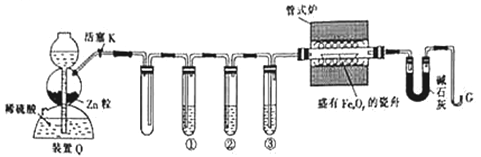
回答下列问题:
(1)装置Q(启普发生器)用于制备H2,还可用于_____(填字母,下同)。
A.生石灰与浓氨水制NH3 B.过氧化钠与水制O2
C.硫化铁固体与稀硝酸制H2S D.大理石与稀盐酸制CO2
(2)①②③中依次盛装的试剂为__________________。
A.KMnO4酸性溶液、浓H2SO4、焦性没食子酸溶液
B.焦性没食子酸溶液、浓H2SO4、KMnO4酸性溶液
C. KMnO4酸性溶液、焦性没食子酸溶液、浓H2SO4
KMnO4酸性溶液中发生反应的离子方程式为_____________。
(3)“加热管式炉”和“打开活塞K”这两步操作应该先进行的是__________,在这两步之间还应进行的操作是_______________。
(4)反应过程中G管逸出的气体是___________,其处理方法是___________。
(5)结束反应时,应该___________,待装置冷却后称量并记录相应数据。
(6)假设反应完全后瓷舟中的固体只有Fe单质,实验中测得了下列数据: ①瓷舟的质量为30.4g;②瓷舟和FexOy的总质量为42.0g;③反应前U形管及内盛物的总质量为98.4g;④反应后U形管及内盛物的总质量为102.0g。由以上数据计算并确定该铁的氧化物的化学式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com