
科目: 来源: 题型:
【题目】常温下,向25mL0.1mol·L-1MOH溶液中逐滴加入0.2mol·L-1HA溶液,中和滴定曲线如图所示(体积变化忽略不计)。回答下列问题:
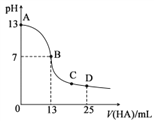
(1)写出MOH在水溶液中的电离方程式:___________。
(2)HA的电离平衡常数为___________ mol·L-l(写出计算结果)。
(3)D点时,溶液中c(A-)+c(HA)___________ 2c(M+)(填“>”“<”或“=”);溶液中离子浓度大小顺序为__________;若此时测得混合溶液的pH=a,则c(HA)+c(H+)=___________mol·L-l(用含字母a的计算表达式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2 。关于该装置的下列说法不正确的是

装置a 装置b
附:⊕表示阳离子,Θ表示阴离子
A. 装置a将太阳能转化为电能,装置b将电能转化为化学能
B. 工作过程中OH-向Y电极周围移动
C. 人体呼出的气体参与X电极的反应:CO2+2e-+H2O=CO+2OH-
D. 反应完毕后恢复到原温度,装置b中电解质溶液的碱性减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L—1NaOH溶液滴定20mL0.l mol·L—1H2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是

A. a点所得溶液中c(H2A)+c(A2—)+c(HA—)=0.1 mol·L—1
B. b点所得溶液中:c(H2A)+2c(H+)=c(A2—)+2c(OH—)
C. 对应溶液的电导率:a<b<c<d
D. 对应溶液水的电离程度:a>b>c>d
查看答案和解析>>
科目: 来源: 题型:
【题目】垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如下图所示。有机物为C6H12O6)。下列说法正确的是

A. A为正极,H2PCA在该电极上发生氧化反应
B. 放电过程中,正极反应为2H2O-4e=4H++O2↑
C. 若1molO2参与电极反应,有2 mol H+穿过质子交换膜进入右室
D. 电池总反应为:C6H12O6+6O2![]() 6CO2↑+6H2O
6CO2↑+6H2O
查看答案和解析>>
科目: 来源: 题型:
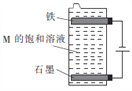
【题目】从下表的阴、阳离子中选出适当的离子组成三种电解质(每种离子只能选用一次),用惰性电极对每种电解质溶液进行电解。回答下列问题:
阳离子 | H+、Na+、Ag+ |
阴离子 | Cl-、SO42-、NO3- |
(1)若阴极放出氢气,阳极放出氧气,且电解后溶液的pH变小,则所选用的电解质的化学式是___________,阴极的电极反应式为___________。
(2)若阴极析出金属,阳极放出氧气,则所选用的电解质的化学式是___________,阳极的电极反应式为_______________________________________________________________。
(3)用如图所示装置电解第三种电解质M的饱和溶液,写出该电解池中发生反应的总化学方程式:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如下:
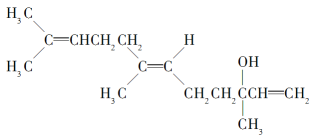
下列关于橙花醇的叙述,错误的是( )
A. 既能发生取代反应,也能发生加成反应
B. 在浓硫酸催化下加热脱水,可生成不止一种四烯烃(分子中含有四个碳碳双键的烯烃)
C. 1 mol橙花醇在氧气中充分燃烧,需消耗470.4 L氧气(标准状况)
D. 1 mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240 g Br2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃、101kPa时,一些物质的燃烧热为,回答下列问题:
化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
△H/(kJ·mol-l) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:_____________________________。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)![]() CH3OH(l)△H=__________。
CH3OH(l)△H=__________。
(3)工业上利用水煤气合成甲醇的主要反应可表示为![]() CO(g)+H2(g)
CO(g)+H2(g)![]()
![]() CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①相同温度条件下,上述反应的化学平衡常数K=___________。
②若容器容积不变,下列措施可增加CH3OH产率的是___________ (填标号)。
a.升高温度
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.再充入0.10molH2和0.05molCO
e.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将___________(填“逆向”“正向”或“不”)移动,化学平衡常数K___________(填“增大”“减小”或“不变”)。
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2molH2,乙中加入lmolCH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2kJ,甲中CO的转化率为a1,乙中CH3OH的转化率为a2,则Q1+Q2=___________,a1+a2=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池是最常见的二次电池,广泛应用于汽车、电动车等领域。
(1)铅蓄电池中,覆盖有PbO2的电极为_______极,另一极覆盖有Pb,电解质为_______。
(2)铅蓄电池完全放电后,正极表面主要覆盖物是_______,充电时铅蓄电池的负极表面发生_______ (填“氧化”或“还原”)反应。
(3)以石墨为电极电解Pb(NO3)2和Cu(NO3)2的混合溶液可制得PbO2。电解时阳极发生的电极反应式为___________________,阴极观察到的现象是_______________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com