
科目: 来源: 题型:
【题目】2017年11月联合国气候大会在德国波恩开幕,CO2的回收利用再一次提上了日程。
I利用CO2制取丙烯(C3H6)
(1)用CO2催化加氢可制取丙烯的原理为:3CO2(g)+9H2(g) ![]() C3H6(g)+6H2O(g) △H。
C3H6(g)+6H2O(g) △H。
已知热化学方程式如下
①2C2H6(g)+9O2(g)=6CO2(g)+6H2O(l) △H1;
②2H2O(g)=2H2(g)+O2(g) ΔH2;
③H2O(g)==H2O(l) △H3;
则制取丙烯反应的△H= ______(用△H1、△H2、△H3表示)。
(2)以稀磷酸为电解质溶液,以石墨为电极,利用太阳能电池将CO2转化为丙烯的工作原理如下图所示。
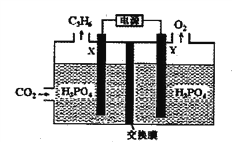
①电解池中的交换膜为_______ :(填“阴”或“阳")离子交换膜,通过交换的离子是_______(填离子符号)。
②阴极的电极反应为_____________________________。
II.利用CO2制取二甲醚(CH3OCH3)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
比n(H2)/n(CO2)]的变化曲线如下左图:
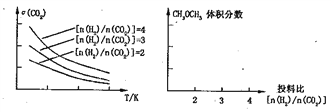
①在其他条件不变时,在右图中画出平衡时CH3OCH3的体积分数随投料比n(H2)/n(CO2)交化的曲线图____________。
②某温度下将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是____________。
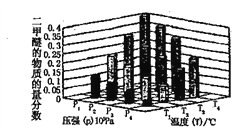
A.P4>P3>P2>P1 B .T4>T3>T2>T1 C.P1>P2>P3>P4 D. T1>T2>T3>T4.
III利用CO2制取甲醇(CH3OH)
用CO2催化加氢制取甲醇的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
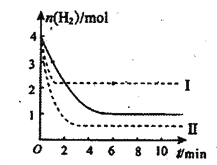
(4)不能证明该反应达到化学平衡状态的是___________。
A.气体的总压强不变
B. CH3 OH(g)和H2O(g)的物质的量之比不变
C.混合气体的密度不再不变
D.单位时间内断裂3NA个H—H健同时形成2NA个C=O键
(5)仅改变某个反应条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线I、II所示。曲线Ⅱ对应的实验条件改变是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯 ) | __________ | __________ |
(Ⅱ)酒精(水) | __________ | __________ |
①检验试剂:A.无水硫酸铜 B.酸性高锰酸钾溶液 C.水 D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸c.新制的生石灰 d.溴水
除杂时,乙烯发生反应的化学方程式为______________________________________。
(2)如图,在左侧试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左侧试管小火加热3~5 min后,改用大火加热,当观察到右侧试管中有明显现象时停止实验。

试回答:在右侧试管中通常加入________溶液,实验生成的乙酸乙酯的密度比水________,是有特殊香味的液体。分离右侧试管中所得乙酸乙酯的操作为________(只填名称)。反应中浓硫酸的作用是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是
A.NH3易液化,液氨常用作制冷剂
B.浓硝酸不稳定,实验室保存在棕色试剂瓶中
C.铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
D.N2是空气中的主要成分之一,雷雨时可直接转化为NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入4molA和2molB发生反应:2A(g)+B(g)![]() 3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A. 4molA+2molB
B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB
D. 3molC+1molD
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)根据结构对有机物进行分类,有助于对其性质的掌握。
①下列有机物中属于芳香烃的是________(填字母),它与苯的关系是________,写出苯与溴发生反应的化学方程式:__________________________。
预测该芳香烃________(填“能”或“不能”)发生该类反应。
![]()
②下列有机物中属于羧酸类的是________(填字母)。

③下列有机物中属于糖类的是________(填字母)。
a.油脂 b.纤维素 c.蛋白质
(2)化合物X的结构简式为 。
。
①一个X分子中有________种等效氢原子。
②X的一种同分异构体Z的结构简式为H2C===CH—CH2OH,请写出Z与Br2发生加成反应的化学方程式: ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到限度的标志是( )
2AB(g)达到限度的标志是( )
A. 单位时间内生成n mol A2同时生成n mol AB
B. 容器内的总物质的量不随时间变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成n mol A2的同时生成n mol B2
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。
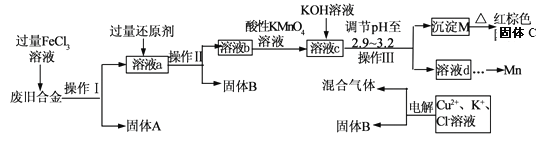
已知:298K时,Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cu(OH)2]=2.2×10一20,
Ksp[Mn(OH)2]=1.9×10—13
回答下列问题:
(1)操作I、Ⅱ、Ⅲ为________,固体B为_________ (填化学式)。
(2)加人过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式__________________。
(3)调节pH至2.9~3.2的目的是分离_________ (填离子符号)
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_________________。
②若用 a mol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液V mL,所得红棕色固体C的物质的量为_________(用含a、v的代数式表示)
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为_________ (填化学式)。
(6)用惰性电极电解时阳极产生标准状况下的气体6.72L,阴极得到的电子数为0.8NA,则生成氧气的物质的量为________ mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】现有①甲烷、②乙烯、③苯、④乙酸、⑤葡萄糖5种有机物,请用序号或按题中要求作答:
(1)分子中所有原子一定都共面的是________。
(2)含氢量最高的有机化合物是________,其电子式为________。
(3)完全燃烧后生成的CO2和水的物质的量之比为1∶1的化合物是________。
(4)其中含有两种不同官能团的有机物是________,官能团的名称分别为________和________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式为 ,关于该有机物的说法不正确的是( )
,关于该有机物的说法不正确的是( )
A. 1 mol该有机物能与2 mol NaOH发生反应
B. 1 mol该有机物能与2 mol Na反应生成1 mol H2
C. 1 mol该有机物能与1 mol NaHCO3反应生成1 mol CO2
D. 1 mol该有机物最多能与4 mol H2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值。

① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
请回答:
⑴ 滴定时,将KMnO4标准液装在右图中的 (填“甲”或“乙”)滴定管中。
⑵ 本实验滴定达到终点的标志可以是 。
⑶ 通过上述数据,计算出x= 。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com