
科目: 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验装置.B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置.

(1)写出装置A中发生反应的化学方程式____________。
(2)C中盛有____________,目的是_____________。
(3)写出装置D中发生反应的化学方程式__________。
(4)指出装置E的错误_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
Ⅰ.直接作燃料
己知:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol, 2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为__________________________________。
Ⅱ. 生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:
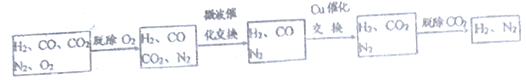
在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4![]() CO+H2 CO+H2O
CO+H2 CO+H2O![]() CO2+H2
CO2+H2
(2) 气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原
因:________________________。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)=______________________。
Ⅲ.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该研究小组在恒温条件下,向2L恒容密闭容器这加入0.2molNO和0.1molCl2,发生如下反应:2NO(g)+Cl2(g) ![]() 2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=___________mol。
2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=___________mol。
设此时NO的转化率为ɑ1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为ɑ2,则ɑ1_________ɑ2 (填“>”、“<”或“=”);平衡常数K_______(填“增大”“减小”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为__________________________ 。
Ⅳ.一种用高岭土矿(主要成分为SiO2、Al2O3,含少量Fe2O3)为原料制备铝铵矾[NH4Al(SO4)2·12H2O]的工艺流程如图所示。回答下列问题:
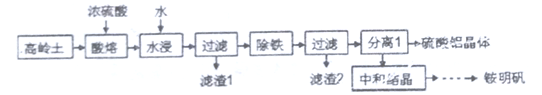
(6)当“酸溶”时间超过40min时,溶液中的Al2(SO4)3会与SiO2反应生成Al2O3·nSiO2,导致铝的溶出率降低,该反应的化学方程式为________________________。
(7)检验“除铁”过程中铁是否除尽的方法是_________________________。
(8)“中和”时,需控制条件为20℃和pH=2.8,其原因是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是( )
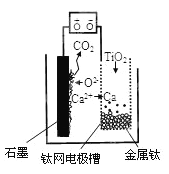
A. 将熔融CaF2—CaO换成Ca(NO3)2溶液也可以达到相同目的
B. 阳极的电极反应式为:C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 石墨为阴极
查看答案和解析>>
科目: 来源: 题型:
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、3molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | V甲 | v乙 | v丙 |
下列说法正确的是( )
A. K乙<K丙 B. c乙=c丙 C. a甲 +a乙<1 D. v甲=v丙
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①能量越低的物质就越稳定②白磷转化成红磷是放热反应。据此,下列判断或说法中错误的是
A.在相同的条件下,红磷比白磷稳定
B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的分子结构不同
D.白磷容易发生自燃而红磷则不会自燃
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验室需要0.5 mol·L-1硫酸溶液450 mL。根据溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制450 mL、0.5 mol·L-1的稀硫酸。计算所需浓硫酸的体积为________ mL(保留1位小数),现有
①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,你选用的量筒是________(填代号)。
(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________________________________________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为:②→①→③→________→ ________→________→________→④(填序号)。_________
(5)在配制过程中,其他操作都准确,下列操作中错误的是________(填代号,下同),能引起误差偏高的有________。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50 mL)。下列叙述错误的是( )
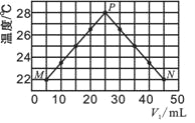
A. 实验的环境温度低于 22℃
B. P点的混合溶液的pH=7
C. 混合溶液的导电能力:M > N
D. 若将CH3COOH改为HCl,P点温度高于 28℃
查看答案和解析>>
科目: 来源: 题型:
【题目】元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com