
科目: 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(2)W的最简单氢化物的电子式为________________。
(3)W、X简单氢化物中沸点较高的是___________(填化学式)。
(4)Y单质与Fe2O3反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为________。
(5)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。
(6)分子式为C4H9Z的有机物其同分异构体有_____种。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学—选修:有机化学基础】
聚芳脂(PAP)是分子主链上带有苯环和脂基的特种工程塑料,在航空航天等领域具有广泛应用。下图是利用乙酰丙酸(CH2COCH2CH2COOH)合成聚芳脂E的路线:

已知:I. ![]()
II. ![]() (R、R′表示烃基)
(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团名称为_____________。
(2)B的分子式为_________________,D的结构简式为___________。
(3)反应②的化学反应方程式为______________,反应类型为_______________。
(4)反应⑤的化学反应方程式为______________,反应类型为_______________。
(5)符合下列条件的C的同分异构体有________种。
a.能发生银镜反应 b.能与NaHCO3溶液反应
c.分子中有苯环,无![]() 结构
结构
在上述同分异构体中,有一种苯环上有两个取代基且核磁共振氢谱图有4组峰的物质,写出该物质与足量NaOH溶液共热反应的化学方程式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(Lmin)。
xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(Lmin)。
(1)B的反应速率v(B)=_____________,X=_____。
(2)A在5min末的浓度是________________。
(3)此时容器内的压强与开始时之比为_________。
Ⅱ.(4)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式____________;
b.指出它分子内的键型_________。
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量 浓度(mol·L-1) | NaOH物质的量 浓度(mol·L-1) | 混合溶 液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请根据要求回答:
(1)②组情况表明,c________ (选填“大于”、“小于”或“等于”)0.2。混合液中离子浓度c(A-)与c(Na+)的大小关系是______________________________________。
(2)从③组实验结果分析,说明HA的电离程度________(选填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是_____________________________。
(3)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。写出该混合溶液中下列算式的结果(不能作近似计算)。c(Na+)-c(A-)=________mol·L-1; c(OH-)-c(HA)=________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】过碳酸钠(![]() )是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:

已知主反应:![]()
![]()
![]() H<0
H<0
副反应:![]() 50℃时
50℃时![]() 开始分解
开始分解

请回答下列问题:
(1)步骤①的关键是_____________,其原因是______________________。
(2)在滤液X中加入适量NaCl固体的目的是________________________。
(3)步骤③中选用无水乙醇洗涤产品的目的是_______________________。
(4)下列物质中,会引起过碳酸钠失效的有____________。
A.![]() B.
B.![]() C.
C.![]() D.HCl
D.HCl
(5)过碳酸钠的产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶液→加入![]() 溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量
溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量![]() g,沉淀的质量
g,沉淀的质量![]() g,则产品中过碳酸钠质量分数的表达式为:___________。
g,则产品中过碳酸钠质量分数的表达式为:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:①![]() H=180.5kJ·
H=180.5kJ·![]()
②C和CO的燃烧热(H)分别为-393.5kJ·![]() 和-283kJ·
和-283kJ·![]()
则2NO(g)+2CO(g)=N2(g)+2CO2(g) H=_________kJ·![]()
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
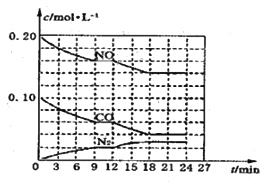
①CO在0—9min内的平均反应速率![]() =__________ mol·L-1·
=__________ mol·L-1·![]() (保留两位有效数字);第12min时改变的反应条件可能为_________。
(保留两位有效数字);第12min时改变的反应条件可能为_________。
A.升高温度 B.加入NO
C.加催化剂 D.降低温度
②该反应在第18min时又达到平衡状态,此时![]() 的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的![]() 转化为HCOOH和
转化为HCOOH和![]() 。已知常温下0.1mol·
。已知常温下0.1mol·![]() 的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)温室效应是导致海平面上升的主要原因,引起温室效应的人为因素主要是 。
(2)为了控制温室效应,各国科学家提出了不少方法和设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减小大气中CO2的浓度。为使CO2液化,可采用的措施是 (填字母)。
A.减压、升温 B.增压、升温
C.减压、降温 D.增压、降温
(3)科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质。如将CO2和H2以1∶4的比例混合,通入反应器。在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式CO2+4H2![]() +2H2O。 若将CO2与H2混合,在一定条件下以1∶3的比例发生反应,可生成某种重要的化工原料和水,该化工原料可能是 (填字母)。
+2H2O。 若将CO2与H2混合,在一定条件下以1∶3的比例发生反应,可生成某种重要的化工原料和水,该化工原料可能是 (填字母)。
A.甲烷 B.乙烯 C.乙醇 D.苯
(4)下列措施能快速、有效地减缓大气中CO2增加的是 。
A.使用天然气等燃料
B.控制全球人口增长
C.植树造林,保护森林
D.立即减少煤和石油的燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com