
科目: 来源: 题型:
【题目】以下是反应:2SO2+O2![]() 2SO3在不同条件下达到平衡状态时SO2的转化率。
2SO3在不同条件下达到平衡状态时SO2的转化率。
压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
试回答下列问题。
(1)关于可逆反应的限度,你能得出什么启示?
________________________________________。
(2)提高该化学反应限度的途径有:_____________________。
(3)要实现SO2的转化率为93.5%,需控制的反应条件是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是 ( )
2Z(g)一定达到化学平衡状态的是 ( )
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成nmol Z,同时生成2nmol Y
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目: 来源: 题型:
【题目】某化合物的化学式为(NH4)2Fe(SO4)2 ,它在水溶液里电离时生成两种阳离子和一种酸根离子
(1)写出硫离子的结构示意图________________;
(2)若向该化合物的水溶液中通入氯气,一种离子很容易被氧化,该离子将变成______;(用离子符号表示)
(3)若向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则该反应的离子方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 油脂都不能使溴水褪色
B. 氨基酸是两性化合物,能与酸、碱反应生成盐
C. 福尔马林可用作食品防腐剂
D. 蔗糖和麦芽糖的水解产物都是葡萄糖
查看答案和解析>>
科目: 来源: 题型:
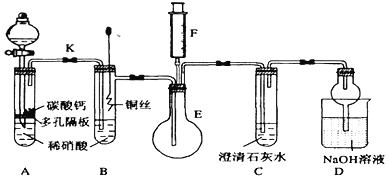
【题目】某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空且充了氧气的注射器。
请回答有关问题:
(1)设计装置A的目的是___________________;为达到此目的,应如何操作?_____________。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是________; B中反应的离子方程式为:________________________;装置B有何优点_____________________________。
(3)装置E和F的作用是________________;为实现此作用,其操作方法是_____________________________。
(4)D装置中NaOH溶液的作用_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2S2O3·5H2O常用作冲洗照相底片的定影剂,实验室以Na2S、Na2CO3、SO2为原料,利用下图装置可制取少量Na2S2O3·5H2O,其实验原理为Na2CO3+SO2=Na2S2O3+CO2;2Na2S+3SO2==2Na2SO3+3S;Na2SO3+S=Na2S2O3。回答下列问题:
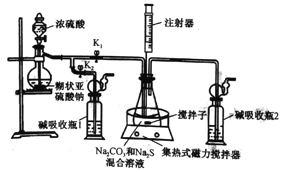
(1)打开K1,关闭K2,将锥形瓶中的溶液加热至35℃,打开滴液漏斗活塞慢慢滴加浓硫酸,锥形瓶中的现象是: ①导管口有气泡冒出;②__________________。
(2)通过注射器取样,监控锥形瓶中溶液pH=7~8,锥形瓶中酸性不能过强的原因是_______。当锥形瓶中溶液的pH接近7时,应进行的操作是__________________________。
(3)反应结束后将锥形瓶中混合液经如下处理可Na2S2O3·5H2O粗晶体:
![]()
①趁热过滤的目的是______________________。
②粗晶体中含有Na2CO3、Na2SO3、Na2SO4等杂质,利用下列提供的试剂,检验粗产品中含有Na2CO3。
可选试剂: a.品红溶液 b.酸性高锰酸钾溶液 c.澄清石灰水 d.NaOH溶液 e.稀硫酸
实验方案:取适量所得粗晶体配成溶液,滴加足量的稀硫酸,将产生的气体依次通过酸性高锰酸钾溶液、_____(填试剂序号)、澄清石灰水,若______(填现象),则证明产品中含有Na2CO3。
(4)粗晶体中Na2S2O3·5H2O质量分数的测定:称取2.500g粗晶体溶于水,配成100mL溶液,取25.00mL溶液于锥形瓶中,用0.4000 mol/L的酸性高锰酸钾标准溶液滴定,消耗标准溶液的体积为10.00mL,Na2S2O3·5H2O的质量分数为______ (忽略杂质对滴定的影响;S2O32-被酸性高锰酸钾溶液氧化为SO42-)。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷元素是组成遗传物质核酸的基本成分之一,而锡元素(Sn)形成的某些化合物能够促进核酸的合成。回答下列问题。
(1)基态磷原子电子占据的最高能层符号是____,占据该能层的电子中能量最高的电子其电子云在空间有_____个伸展方向,原子轨道呈_____形。
(2)锡元素可形成白锡、灰锡、脆锡三种单质。研究灰锡晶体的结构最常用的仪器是_____。灰锡晶体与金刚石结构相同,但灰锡不稳定,其原因是_____。
(3)固态PCl5结构中存在PCl4+和PCl6-两种结构单元,其晶胞如图所示。
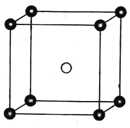
①PCl4+的空间结构为________,PCl3的键角小于PCl4+键角的原因为___________。
②已知晶胞的边长为anm,阿伏加德罗常数值用NA表示。则PCl4+和PCl6-之间的最短距离为_______pm,固态PCl5的密度为______g.cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙苯(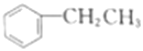 )是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
)是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
乙苯脱氢制苯乙烯:
![]() △H1=akJ/mol
△H1=akJ/mol
乙苯氯化制β-氯苯乙烷:
![]() △H2=bkJ/mol
△H2=bkJ/mol
回答下列问题:
(1)利用下表提供的数据计算a=_____。乙苯脱氢制苯乙烯的反应在_____(填“高温”或“低温”)有利于其自发进行。
化学键 | C-H | C-C | H-H | C=C |
键能/kJ/mol | 412 | 348 | 436 | 612 |
(2)已知
![]() +HCl(g)
+HCl(g)![]()
![]() △H=-54kJ/mol
△H=-54kJ/mol
H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol 则b=______________。
(3)T℃,将nmol乙苯加入到体积为V L的恒容容器中,发生脱氢反应,容器内压强随时间变化如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
压强/×100 kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
平衡时容器内气体的总物质的量为______,乙苯的转化率为______%。
(4)工业由乙苯脱氢制苯乙烯实际上是在恒压密闭容器中进行的。将m mol乙苯通入某恒压密闭容器中(反应过程中维持压强为p),乙苯的平衡转化率随温度变化如右图所示:
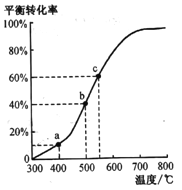
①在a点所示的条件下,向该容器中通入25L水蒸气,则乙苯的转化率______(填“变大”“变小”或不变),生成苯乙烯的速率________(填“变大”“变小”或不变)。
②b点气体总体积______(填“<”“>”或“=”)c 点气体总体积。
③c点平衡常数Kp=_______(用平衡分压代替平衡浓度,平衡分压=物质的量分数×总压)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
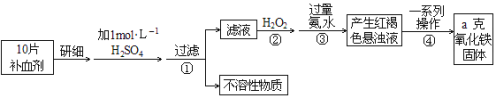
请回答下列问题:
(1)步骤②加入过量H2O2的目的:________________________________________;
(2)步骤③中反应的离子方程式:________________________________________;
(3)步骤④中一系列处理的操作步骤:________、洗涤、______、冷却、称量。
(4)实验中用浓硫酸配制1 mol/L的稀硫酸,配制时用到的定量玻璃仪器有________、__________。
(5)若实验无损耗,则每片补血剂含铁元素的质量___________g(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放。蚀刻液主要有酸性的(HCl-H2O2)、传统的FeCl3型(HCl-FeCl3)等方法.蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失.几种蚀刻废液的常用处理方法如下:
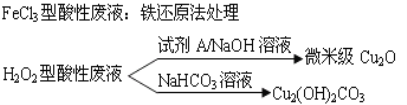
(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有_______________、__________________.(用离子方程式表示)。
(2)HCl-H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:__________。
(3)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com