
科目: 来源: 题型:
【题目】实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸。

(1)按气体流向由左到右排列,各装置的连接顺序为(填写A~E序号):__接__接___接__接__。
(2)装置连接好后,应该首先进行的实验操作是____________________________________________。
(3)A装置烧瓶中反应的离子方程式是_________________________________________。
(4)E中盛装的试剂是________,其作用是_________________________________________。
(5)停止反应后,还有铁丝剩余。为检验FeCl3的生成,并最终得到FeCl3溶液,甲同学设计以下实验步骤:
a.待B装置玻璃管冷却后,将管中物质用水溶解,________(填操作方法)除去不溶物;
b.取少量滤液,滴加________溶液,溶液呈现红色,以此检验Fe3+;
c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-。
(6)乙同学认为甲的实验设计不能最终得到FeCl3溶液,其理由是(写出相应的离子反应方程式)__________________________________________________________________。
你认为还选择下列哪些试剂才能制得较为纯净的FeCl3溶液________。
A.KMnO4(H+) B.Fe C.H2O2 D.Cl2 E.盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 分子晶体中的每个分子内一定含有共价键
B. 原子晶体中的相邻原子间只存在非极性共价键
C. 离子晶体中可能含有共价键
D. 金属晶体的熔点和沸点都很高
查看答案和解析>>
科目: 来源: 题型:
【题目】钠、氯及其化合物有如下转化关系,请按要求填空:
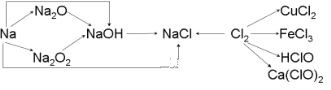
(1)一小块金属钠投入水中(含酚酞)的反应方程式是:______________,现象:__________________。
(2)写出Na2O2生成NaOH的反应方程式:__________________________________。
(3)新制的氯水滴入AgNO3溶液中,观察到____________________现象,说明氯水中含有____________。
(4)工业上用氯气和石灰乳反应制漂白粉,漂白粉的有效成分是__________,漂白粉长时期露至在空气中会失效,写出漂白粉失效的方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
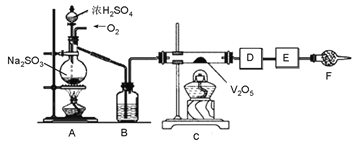
完成下列填空:
(1)A处的化学反应方程式为_______________,仪器F的名称为_____。
(2)根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:__________,E:_________。

(3)用amolNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间O2,最后测得E处装置增重bg,则此时SO2的转化率为__________%(用含a、b的代数式表示)。
(4)若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________。
(5)实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。
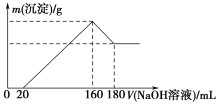
(1)加入NaOH溶液0~20 mL时的反应的离子方程式为________________,160~180 mL时的反应的离子方程式为____________________________。
(2)合金中Mg的质量为________g,所用HCl的物质的量浓度为________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有三种液态混合物:①乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃);②汽油和水③溴水.在实验室分离这三种混合物的正确方法依次为( )
A.蒸馏、分液、萃取
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
查看答案和解析>>
科目: 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4-+H+ ka1 HC2O4-
HC2O4-+H+ ka1 HC2O4-![]() C2O42-+H+
C2O42-+H+![]() 常温下向某浓度的草酸溶液中逐滴加入一定量浓度KOH溶液,所得溶液H2C2O4、HC2O4-、C2O42-三种微粒物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
常温下向某浓度的草酸溶液中逐滴加入一定量浓度KOH溶液,所得溶液H2C2O4、HC2O4-、C2O42-三种微粒物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
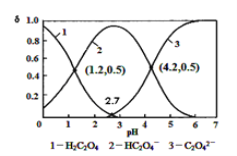
A. pH=1.2溶液中:c(K+)+c(H+) = c(OH-)+c(H2C2O4)(由图知)
B. pH=2.7溶液中: 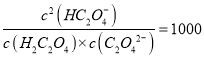
C. 将相同物质的量KHC2O4和K2C2O4固体溶于水可配得pH为4.2混合液
D. 向pH=1.2溶液中滴加KOH溶液,pH增大至4.2的过程中水电离程度一直增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生社团根据老师的指导进行实验研究:一块下衬白纸的玻璃片上有a、b、c、d四个位置,分别滴加浓度为0.1 mol/L的四种溶液各1滴,每种彼此分开,形成一个个小液滴。在圆心e处放置2粒芝麻粒大小的KMnO4晶体,然后向KMnO4晶体滴加一滴浓盐酸,并将表面皿盖好。可观察到a、b、c、d、e五个位置均有明显反应。
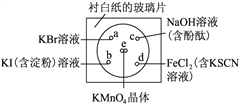
完成下列填空:
(1)e处立即发生反应,化学方程式如下,请配平,并标出电子转移方向和数目______。
![]() KMnO4+
KMnO4+![]() HCl(浓)→
HCl(浓)→![]() KCl+
KCl+![]() MnCl2+
MnCl2+![]() Cl2↑+
Cl2↑+![]() H2O
H2O
(2)在元素周期表中Cl、Br、I位于___________________ 族 ,它们最高价氧化物所对应水化物酸性最强的是__________________(填化学式)。
(3)b处实验现象为_____________________。d处反应的离子方程式为__________________,通过此实验________(填“能”或“不能”)比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱。若能,则其氧化性由强到弱的顺序是___________________________________。
(4)常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如下图所示,下列有关叙述正确的是__________。
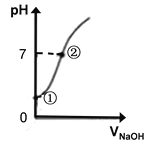
A.①处所示溶液中存在的电离平衡不止一个
B.由①到②的过程中,溶液由酸性逐渐变为碱性
C.由①到②的过程中,水的电离程度逐渐减弱
D.②处所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目: 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com