
科目: 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:
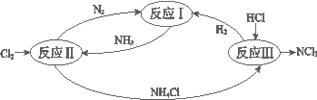
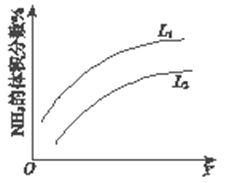
(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1。上图是反应I中平衡混合气中NH3的体积分数(V%)随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中横坐标X代表的是__________(填“温度”或“压强”),L1__________ L2(填“>”或“<”或“=”) 。
2NH3(g) ΔH=–92 kJmol-1。上图是反应I中平衡混合气中NH3的体积分数(V%)随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中横坐标X代表的是__________(填“温度”或“压强”),L1__________ L2(填“>”或“<”或“=”) 。
(2)反应II其中一步反应为2NH3(g)+3Cl2(g) =N2(g)+6HCl(g)ΔH=–462 kJmol-1
已知:![]() 断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
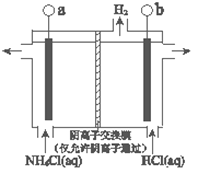
(3)反应III是利用下图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3+3H2↑。
NCl3+3H2↑。
①b接电源的_______(填“正”或“负”)。
②阳极反应式是_______。
(4)反应III得到的NCl3可以和NaClO2制备ClO2,同时生成NH3,该反应的离子方程式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生应用如下图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
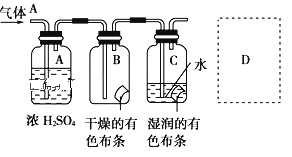
(1)该项研究(实验)的主要目的是__________________________________。
(2)浓H2SO4的作用是 _______________________,与研究目的直接相关的实验现象是___________________。
(3)从物质性质的方面来看,这样的实验设计还存在不妥之处,有隐患,隐患表现为__________________。请在D处以图的形式表明克服隐患的措施__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4↑+10CO↑,上述反应中的各种物质,属于酸性氧化物的有__。
(Ⅱ)(3)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如右图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象:_______,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为__________________.
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】电池在现代社会中具有极其广泛的应用。
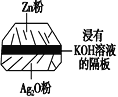
(1)银锌蓄电池(右图)是人造卫星所使用的高能电池之一,其放电时的反应是Zn+Ag2O===ZnO+2Ag。电解质溶液为KOH溶液。则该电池的负极材料是________,放电时正极的电极反应式为________________,放电时负极区的pH________(填“增大”、“减小”或“不变)。
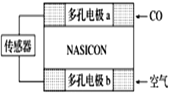
(2)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________________________________。正极发生的电极反应式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题:
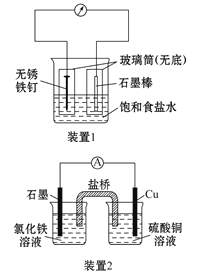
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______(填氧化、还原);向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为___________________________________。
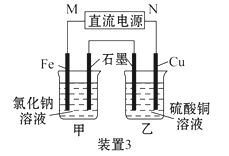
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为___________________________________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为____________ mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈(Fe2O3)。现将一表面生锈的铁件放入盐酸中,除去铁锈的化学反应的离子方程式为:___________。
(2)利用如图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时, 转移的电子数为_______NA。
(4)铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:
![]()
![]()
![]()
![]() 尾气处理
尾气处理
(1)写出实验室制取氯气的离子方程式____________________________,NA表示阿伏加德罗常数的值,若有4 mol的HCl被氧化,则转移的电子总数为______;将足量的MnO2投入含2 mol HCl的浓盐酸中,充分加热,可生成的Cl2________(填“>”“=”或“<”)0.5 mol。
(2)现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C.NaOH溶液,则Y溶液应选用________(填字母),X溶液的作用是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A. 离子晶体中阴阳离子间的作用力为静电引力
B. 离子键没有方向性和饱和性
C. 在氯化铯晶体中无CsCl分子单独存在
D. CaF2晶胞中F-的配位数为4
查看答案和解析>>
科目: 来源: 题型:
【题目】元素A原子的L电子层比元素B原子的L电子层少 3个电子,B元素原子核外电子总数比A元素原子核外电子总数多5个,则A、B形成的化合物的化学式可能为( )
A.B2A3B.B3A2
C.A2B3D.BA2
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,将等体积的NO和O2一同置于试管中,并将试管倒立于水中,充分反应后剩余气体的体积约为原气体总体积的( )
A. 1/4 B. 3/4
C. 1/8 D. 3/8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com