
科目: 来源: 题型:
【题目】用标准浓度的NaOH溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定浓度比实际浓度偏高的是( )
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗,②锥形瓶中有少量蒸馏水,实验时没有烘干处理,③取未知浓度盐酸的酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗,④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失,⑤滴定后读数时,俯视读数.
A. ①④ B. ②③ C. ①③ D. ④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】在T℃时,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为____________。
②该反应达到平衡的标志是______。
a.气体的平均相对分子质量不变
b.气体的密度不变
c.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
d.气体的总物质的量不变
(2)T℃时,在下列密闭容器中加入相应的物质进行实验,中间的隔板可以自由滑动。

①若左室中气体的平均相对分子质量一直保持不变,则反应开始前H2O(g)、H2(g)的物质的量之比是__________。
②反应在达到平衡时,中间的隔板所处的位置是________。
a.1~1.5之间 b.1.5处 c.1.5~2之间
(3)已知:I.破坏1mol共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C≡O | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如图所示:
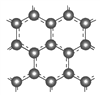
某同学构想:通过下列装置实现C(s)+H2O(g) ![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
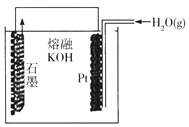
①按该考生的构想,石墨电极发生的反应式为_______________。
②这个构想成立吗?说明理由: _______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,水的电离达到平衡:H2O![]() H++OH-。下列叙述正确的是( )
H++OH-。下列叙述正确的是( )
A. 向水中加入少量NH4Cl固体,平衡向正向移动,Kw变大
B. 向水中加入少量NaOH固体,平衡向正向移动,c(OH-)增大
C. 向水中加入少量固体硫酸氢钠,平衡向逆向移动,c(H+)增大
D. 向水中加入少量NaCl固体,平衡向正向移动,c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L的密闭容器中发生:3A(g)+B(g) ===2C(g) 的反应,若最初加入A和B都是4 mol,A的平均反应速率是0.12 mol·L-1·s-1,则10 s后容器中B的浓度为
A. 2.8 mol·L-1 B. 1.6 mol·L-1 C. 3.2 mol·L-1 D. 3.6 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是( )
A. K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大
B. 比较Ksp与离子积Qc的相对大小,可判断难溶解电解质在给定条件下沉淀能否生成或溶解
C. K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了
D. 弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka·Kh
查看答案和解析>>
科目: 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL 烧碱溶液于锥形瓶中并加几滴酚酞指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
(1)正确的操作步骤是(填写字母) ____→____→____→D→____。
(2)操作D中液面应调整到_______________;尖嘴部分应________________。
(3)以下操作会造成所测烧碱溶液浓度偏低的是(____)
A.酸式滴定管未用待装溶液润洗 B.碱式滴定管未用待装溶液润洗
C.锥形瓶未用待装溶液润洗 D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4)该烧碱样品的纯度计算式是__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年12月,华为宣布: 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是
C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 充电时,LiCoO2极 发生的电极反应为: LiCoO2-xe-=Li1-xCoO2+xLi+
D. 废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于1.5mol氢气的叙述错误的是( )
A.体积是33.6LB.质量是3g
C.所含电子的物质的量是3molD.氢原子数目约为3×6.02×1023个
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)偏铝酸钠的水溶液呈___(填“酸”“中”或“碱”)性,原因是(用离子方程式表示):________________;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____(填“促进”或“抑制”)其水解。
(2)明矾可用于净水,原因是(离子方程式表示):__________________。
(3)用离子方程式表示泡沫灭火器灭火原理:__________________。
(4)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):____________。
(5)碳酸氢钠溶液中离子浓度由大到小的顺序是:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com