
科目: 来源: 题型:
【题目】辉铜矿(主要成分是Cu2S)含铜量高,是最重要的炼铜矿石。
I.已知: ①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ.mol-1
②Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=-217.4kJ.mol-1
(1)Cu2S与Cu2O反应生成Cu和SO2的热化学方程式为_____________。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反应①:CH3OCH3(g)+CO(g)![]() CH3COOCH3(g) △H1
CH3COOCH3(g) △H1
反应②:CH3COOCH3(g)+2H2(g)![]() CH3OH(g)+C2H5OH(g) △H2
CH3OH(g)+C2H5OH(g) △H2
(2)压强为pkPa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图1所示,则△H1____(填“>”或“<”,下同)0、△H2_____0。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示。在300~600K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是____________。

(3)若压强为pkPa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3和1molCO发生反应①,2min时达到平衡,则前2min内CH3COOCH3的平均生成速率为_________,该条件下平衡常数K=_____________。
(4)以铜为原料,利用电解法可制取具有广泛用途的光电材料——纳米Cu2O,其工作原理如图3所示。则b是_______极,电解时阳极的电极反应式为______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】实验题
(一)实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中所含杂质与酸不反应,请根据实验回答:
(1)将准确称取的5g烧碱样品配成100 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的玻璃仪器有:____________、_____________。
(2)取10.00 mL待测液,选择右图中_________(填A或B)来移取。

(3)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。滴定达到终点的标志是:_________。
(4)根据下列数据,烧碱的纯度为:_______________________(纯度=纯物质的质量/样品的质量×100%)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(二)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)计算:血液中含钙离子的浓度为_____mol·L-1。
【答案】 胶头滴管 100mL容量瓶 A 锥形瓶内颜色的变化 最后一滴盐酸滴进锥形瓶内红色褪去且30s不复原 80% 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 酸式 2.5×10-3
【解析】(一)(1)配制一定浓度的溶液,需要用到100mL的容量瓶,还需要胶头滴管定容。
(2)待测的氢氧化钠溶液应该使用碱式滴定管,选择A。
(3)滴定时眼睛应该注意锥形瓶内液体颜色的变化,达到终点时要及时停止滴定。滴定终点的现象为:溶液红色褪去且30s不复原,所以答案为:最后一滴盐酸滴进锥形瓶内红色褪去且30s不复原。
(4)两次滴定加入的盐酸的体积分别为19.90mL和20.10mL,所以平均为20.00mL,所以HCl的物质的量为20×0.5÷1000=0.01mol,所以氢氧化钠为0.01mol,因为配了100mL溶液取出10mL进行的滴定,所以原来的氢氧化钠为0.1mol,质量为4g,质量分数为4÷5=80%。
(二)(1)KMnO4滴定H2C2O4的方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑ + 8H2O,对应的离子方程式为:2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2
(2)高锰酸钾具有强氧化性,会氧化碱式滴定管下端的橡胶管,所以只能用酸式滴定管盛放。
(3)根据反应的整个过程,得到如下的关系式Ca2+~CaC2O4~H2C2O4~2/5 KMnO4,所以Ca2+是KMnO4的5/2倍。高锰酸钾为20×1×10-4÷1000=2×10-6mol,所以Ca2+为5×10-6mol,所以浓度为5×10-6÷0.002=2.5×10-3mol/L。
【题型】实验题
【结束】
20
【题目】盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol· L-1;
H2CO3的电离常数Ka1=4.2×10-7mol·L-1、Ka2=5.6×10-11mol·L-1。
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因________________。
②常温下,物质的量浓度相同的下列四种溶液:a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、碳酸氢钠溶液。其pH由大到小的顺序是:___________(填序号)。
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则表示醋酸溶液pH变化的曲线是___ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。则 m1 ___ m2 ( 选填“<”、“=”、“>”)。

(3)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图如下,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是_______;该醋酸溶液稀释过程中,下列各量一定变小的是______________。

a.c(H+) b.c(OH-)
c. ![]() d.
d. 
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸镓在激光材料的制备中已成为重要的基础和主要原料。以废催化剂GCS(主要成分为Ga2O3、Cr2O3和SiO2)为原料制备硝酸嫁晶体的工艺流程如下:

(1)滤渣的主要成分是______(写化学式),用稀氨水调节溶液pH至3.0~3.5之间的目的是________。
(2)用硝酸溶解时,温度应控制在40~80℃,实验室控制该温度区间的方法是______;温度高于80℃,溶解速率减慢,其原因是____________。
(3)采用减压蒸馏的目的是_________________。
(4)催化剂GCS可用于催化热乙烯还原一氧化氮,以消除尾气排放对大气的污染,写出该反应的化学方程式:________________。
(5)用硝酸镓制备含镓、铱和铂的催化剂可以有效地催化正庚烷转化为甲苯,该反应的化学方程式为________________。
(6)硝酸镓晶体加热过程中,固体失重率[失重率=![]() ]随温度的变化关系如图所示。A点时,固体物质的化学式为_________,B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则该变化的总反应方程式为___________。
]随温度的变化关系如图所示。A点时,固体物质的化学式为_________,B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则该变化的总反应方程式为___________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,正确的是
A. H2SO4的摩尔质量是98
B. 等质量的O2和O3中所含的氧原子数相同
C. 等质量的CO与CO2中所含碳原子数之比为7︰11
D. 98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】两种金属A和B,已知A,B常温下为固态,且A,B属于质软的轻金属,由A,B熔合而成的合金不可能具有的性质有( )
A. 导电、导热、延展性较纯A或纯B金属强
B. 常温下为液态
C. 硬度较大,可制造飞机
D. 有固定的熔点和沸点
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中:A.KI(s) B.C2H5OH(l) C.Cl2(g) D.CH3COOH(l)E.BaSO4(s) F.NaHSO4(aq) G.石墨(s) H.蔗糖(s) I.NaOH(l) J.硫酸 K.盐酸
(1)属于非电解质的是____________(填序号,下同),属于强电解质的是____________,属于弱电解质的是____________。
(2)能直接导电的是________________,电解质中能溶于水,且水溶液能导电是________________。
【答案】 BH AEI J D FGIK ADIJ
【解析】电解质是酸、碱、盐和活泼金属氧化物,非电解质是除了电解质之外的所有化合物。强电解质是强酸、强碱和盐,弱电解质是弱酸、弱碱和水。注意:单质既不是电解质也不是非电解质。(1)属于非电解质的是乙醇和蔗糖,强电解质是碘化钾(盐)、硫酸钡、氢氧化钠和硫酸(注意:F是硫酸氢钠溶液,K是HCl溶液,都属于混合物),弱电解质是醋酸。
(2)固体导电要求是金属或者石墨,熔融状态导电的要求是离子化合物,溶液导电要求是溶液中存在能只有移动的离子(电解质电离)。所以直接导电的是硫酸氢钠溶液、石墨、氢氧化钠溶液、盐酸。属于电解质,能溶于水,且能导电(本条件多余,电解质能溶于水,则其溶液一定导电)的是碘化钾、醋酸、氢氧化钠、硫酸。硫酸钡不溶。
【题型】填空题
【结束】
18
【题目】根据下列事实,完成相关的离子方程式或化学式,必要时可加一定文字说明:
(1)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂_____________________。
(2)泡沫灭火器的化学原理________________________________________________。
(3)热的纯碱溶液清洗油污___________________________________________。
(4)加热蒸干FeCl2水溶液并灼烧,得到物质的化学式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子, X、Y、Z、P分别为构成生物大分子的基本单位,请回答下列问题:
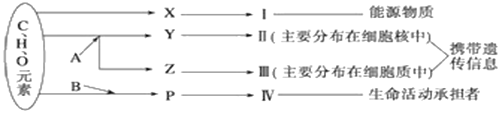
(1)Ⅰ在小麦种子中主要是指______,其基本单位X是______。
(2)A代表的元素是____,Ⅱ是____,Ⅲ是RNA,Z是_____。
(3)Ⅳ一定含有的元素有______。P的结构通式是______,图中由P形成Ⅳ的反应方式称为____,Ⅳ的特定功能的发挥与其_____结构有关。若P的平均相对分子质量r,由多个P形成m条肽链,经盘曲折叠形成了相对分子质量为e的Ⅳ,则Ⅳ分子中肽键的数目是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com