
科目: 来源: 题型:
【题目】可逆反应A(g)+B ![]() C(g)+D 中,A、C都是无色气体,当达到平衡时,下列叙述错误的是
C(g)+D 中,A、C都是无色气体,当达到平衡时,下列叙述错误的是
A. 若增大A的浓度,平衡体系颜色加深,说明D是有颜色的气体
B. 增大压强,平衡不移动,说明B、D必是气体
C. 若B是气体,增大A的浓度会使B的转化率增大
D. 升温,C的质量分数减小,说明正反应是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】过量的锌粉与一定量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.加入适量的水B.加入氯化钠溶液
C.加入少量CuSO4溶液D.加入等体积的浓度较大的盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s)-Q(Q>0),下列叙述中,正确的是
2Z(g)+W(s)-Q(Q>0),下列叙述中,正确的是
A. 反应过程中,气体的密度始终不变
B. 当容器中气体压强不变时,反应达到平衡状态
C. 当2v正(X)=v逆(Z)时,反应达平衡状态
D. 升高温度,v(正)增大、v(逆)减小,平衡向正反应移动
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将 20.0 g 质量分数为 14.0%的 KNO3溶液与 30.0 g 质量分数为 24.0%的 KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数_________。
(2)混合后溶液的物质的量浓度_______。
(3)在1000g水中需溶解______molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
(4)标况下44.8LHCl溶于水配成500mL溶液。计算:
①HCl的物质的量____________________;
②所得溶液中溶质的物质的量浓度____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在托盘天平的两盘,放上质量相等的A、B两烧杯,调至平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放入下述各组物质,结果天平仍保持平衡的是()
A. 0.5molNa和0.5molMg B. 0.1molZn和0.1molAl
C. 8.4gMgCO3和8.4gNaHCO3 D. 10gCaCO3和10gMgCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是一种有机材料中间体。实验室由芳香化合物A制备H的一种合成路线如下;
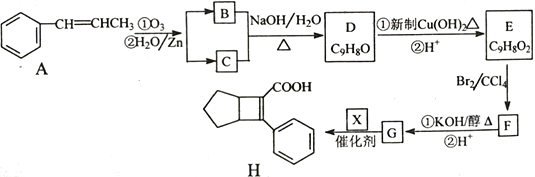
已知:①![]()
②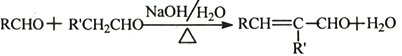
③![]()
请回答下列问题:
(1)芳香族化合物B的名称为__________,C的同系物中相对分子质量最小的结构简式为__________。
(2)由F生成G的第①步反应类型为_______________。
(3)X的结构简式为_______________。
(4)写出D生成E的第①步反应化学方程式____________________________。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有__________种,写出其中任意一种的结构简式_____________________。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2
②其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。
(6)写出用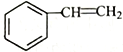 为原料制备化合物
为原料制备化合物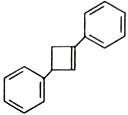 的合成路线,其它无机试剂任选_____________________________________________。
的合成路线,其它无机试剂任选_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/3。
⑴此浓盐酸的物质的量浓度是多少?_______________(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL? ______________(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):_____________________ 。
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目: 来源: 题型:
【题目】日常生活中常用到化学知识,下列说法不正确的是( )
A. 白色污染、绿色食品中的“白”、“绿”均指相关物质的颜色
B. 用食醋可以除去热水壶中的水垢
C. 聚氯乙烯塑料有毒,不可用于制食品包装袋
D. 新制的Cu(OH)2可以检测糖尿病患者尿液中是否含有葡萄糖
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学学习小组在帮助老师整理实验室的化学试剂时,发现一盛无色盐溶液的试剂瓶,标签破损如右图,该小组根据已掌握的知识,对药品作出猜想,并设计实验验证。

(1)该实验药品为中学化学常用试剂,推测它的阳离子化合价为______________________。
(2)同学们做出以下三种推测。
猜想1:Na2SO4
实验设计: 进行……,.证明是Na2SO4溶液;
猜想2: K2SO4
实验设计:____________________________,证明是K2SO4溶液;
猜想3; (NH4)2SO4
实验设计:____________________________,证明是(NH4)2SO4溶液。
(3)通过实验发现“猜想3”成立,已知(NH4)2SO4受热易分解,该小组拟用下图所示装置探究其分解产物。(夹持和加热装置略)

实验I:装置B 盛0.5000mol/L盐酸50.00mL,通入N2排尽空气后,将装置A 加热至260℃一段时间,停止加热,停止通入N2,品红溶液不褪色,取下装置B,用0.1000mol/LNaOH溶液滴定剩余盐酸,消耗NaOH 溶液50.00mL。经检验滴定后的溶液中无SO42-。

①请从右图选择盛放0.1000mol/LNaOH 溶液的滴定管____________(填“甲”或“乙”)。
②装置B 内溶液吸收气体的物质的量是_____________________mol。
实验Ⅱ:通入N2排尽空气后,将装置A 加热到400℃,至固体无残留,停止加热,停止通入N2,观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。
①装置E 的作用是____________________________。
②A、D之间的导气管内的少量白色固体是____________________________。
③有同学提出在AD之间需要增加一个防倒吸的安全瓶,老师说不需要,原因是____________________________。
④进一步研究发现,气体产物中无氮氧化物,则(NH4)2SO4在400℃分解的化学方程式是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化铜是一种常用试剂。如:利用新制氢氧化铜验证乙醛的还原性。
(1)新制氢氧化铜悬浊液的配制:在试管里加入10%的氢氧化铜溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡。这样操作的目的是________________________。
(2)下面是某研究性学习小组开展的探究性学习活动:
提出问题:对“乙醛与新制氢氧化铜悬浊液反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,进行了如下探究:
提出猜想:________________________。
查阅资料:①氧化亚铜属于碱性氧化物;
②+1价的铜离子在酸性条件下易发生自身氧化还原反应;
③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硝酸中,观察是否有残渣;
方案3:称取该红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次,直到固体恒重,称得质量为bg,比较a、b的大小;
方案4:取红色沉淀放于大试管里,加入酸化的硝酸银溶液,观察是否有银白色的银析出。
你认为合理的方案是____________。
(3)质量分数为11.6%的某饱和一元醛水溶液5g,跟足量新制的Cu(OH)2悬浊液反应,生成Cu2O1.44g。这种醛是________,结构简式为________。它与足量新制Cu(OH)2悬浊液反应的化学方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com